Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik: Gangunsicherheit und Sturzneigung im Alter – immer nach relevanten Komorbiditäten fahnden
Folge 73 der Reihe Zertifizierte Kasuistik
von Amelie C. Krause,Michael Kowar, Kai Wilhelm, Udo Schmitz und Andreas H. Jacobs
Erläuterungen
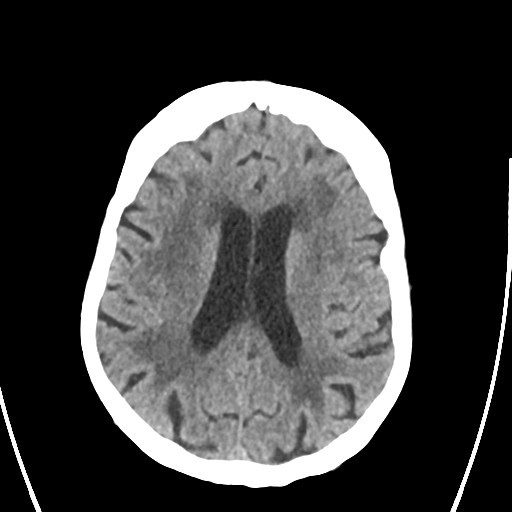
Zur Abklärung der Stürze der Patientin wurde zuerst eine cranielle Computertomograhie (cCT) durchgeführt. Diese zeigte die Zeichen einer ausgeprägten vaskulären Encephalopathie (siehe Abbildung 2) als Ursache für das vaskuläre Parkinson-Syndrom und die Sturzneigung.
Aufgrund der Vitalzeichen, der Immobilität, der bestehenden Dyspnoe und der erhöhten D-Dimere wurde mittels Computertomographie des Thorax eine Lungenarterienembolie ausgeschlossen. Auf den mit erfassten Oberbauchanteilen Abbildung 1 stellt sich ein pathologischer Befund (siehe Pfeile in Abbildung 1) dar.
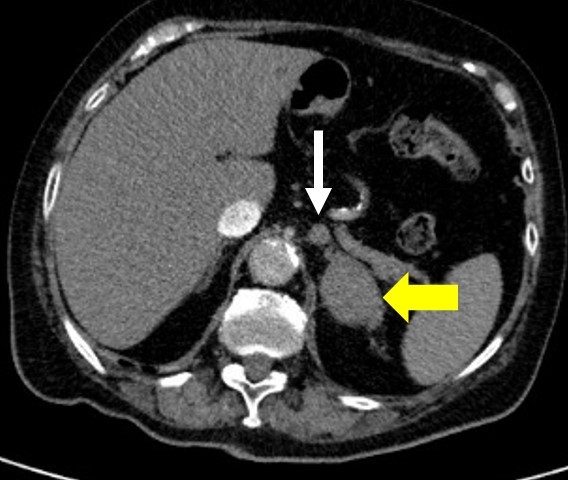
Wir fanden bei der Patientin einen linksseitigen Nebennierentumor mit paraaortalen Lymphknoten. Nebennierentumore gehören zu den häufigsten Tumoren insgesamt. Ihre Gesamtprävalenz im Erwachsenenalter beträgt schätzungsweise 3 Prozent, bei über 80-Jährigen sogar bis zu 10 Prozent. Aufgrund der immer besseren Bildgebung werden Inzidentalome, also „zufällig“ entdeckte Raumforderungen der Nebenniere, in bis zu 4 Prozent der Untersuchungen festgestellt (1, 2, 3). Abzugrenzen sind diese von primär klinisch apparenten Nebennierentumoren. Neben benignen Tumoren wie Adenome, sind andere Raumforderungen wie Malignome (Adrenokortikale Karzinom oder Metastasen eines anderen Primarius) abzugrenzen (1, 2).
Ungefähr 80 Prozent der Inzidentalome sind endokrin inaktiv und benigne. Meist handelt es sich hierbei um Adenome, die keiner spezifischen Therapie bedürfen. Insgesamt sind circa 15 Prozent der zufällig gefundenen Nebennierentumore funktional. Rund 9 Prozent produzieren diese häufig niedrigschwellig und autonom Cortisol. 4 Prozent sind Phäochromozytome, 2 Prozent führen hauptsächlich zu Hyperaldosteronismus. Nur sehr selten steht Überproduktion von Sexualhormonen im Vordergrund (1, 2, 3).
Weiterer diagnostischer Ablauf bei Inzidentalom der Nebenniere
Nach der Diagnosestellung „Inzidentalom“ sollte eine weitere Diagnostik folgen, wenn der Tumor 1 cm oder größer ist. Eine hormonelle Aktivität beziehungsweise Malignität sollte jedoch regelmäßig ausgeschlossen werden (1, 4).
Radiologische Diagnostik
Die Sonografie ist zur Suche von Nebennierenmetastasen als alleiniges bildgebendes Verfahren nicht geeignet, da sich die Nebennieren insbesondere bei noch kleinen Tumoren oder Organvergrößerungen häufig nicht ausreichend beurteilen lassen. Große Nebennierenkarzinome sind als inhomogene Raumforderung darstellbar. Als morphologische Benignitätskriterien im Sinne eines Inzidentaloms gelten in der CT ein Durchmesser < 3,0 cm, eine rundliche Form, eine glatte Begrenzung und eine homogene Organdichte. Wegen des vergleichsweise hohen intrazytoplasmatischen Fettgehaltes haben Inzidentalome in der nativen CT meist Dichtewerte < 10 HE (7).
Die native CT Untersuchung (Abb. 1) ist jedoch zur Abklärung einer Nebennierenraumforderung nicht ausreichend, sodass ergänzend eine Dynamische CT-Untersuchung nach intravenöser Kontrastmittelapplikation erfolgen sollte. Inzidentalome zeigen im Vergleich zu Malignomen ein rascheres KM-Auswaschverhalten („Washout“), sodass sie auf Spätaufnahmen (nach 10 - 20 min) niedrigere Dichtewerte als Malignome haben. Bleibt die Differenzierung zwischen Inzidentalom und Malignom auch nach der dynamischen KM-CT- Untersuchung unklar, sollte eine weitere Abklärung mittels MRT erfolgen.
MRT Abdomen
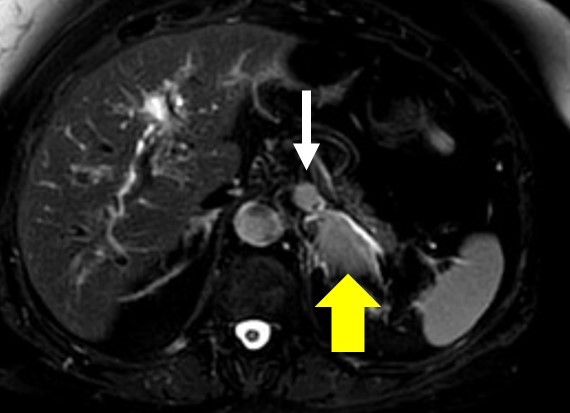
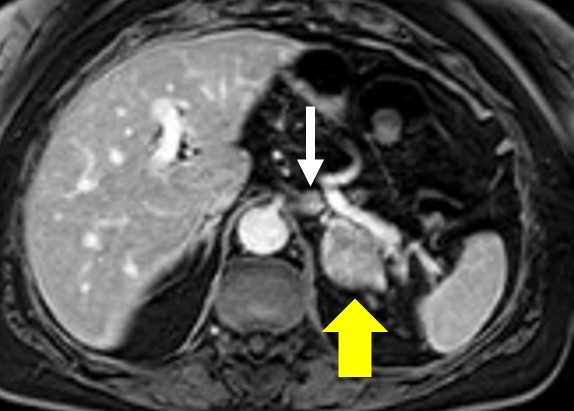
Ein anschließend veranlasste MRT-Untersuchung des Abdomens bestätigte die Raumforderung der linken Nebenniere sowie die vergrößerten Lymphknoten paraaortal links (siehe Abbildungen 3 a, b).
Ausweislich der Fett-supprimierten (Abbildung 3a) sowie speziellen doppelecho-Chemical-Shift-Unter-suchungssequenzen ließ sich ein Fettanteil im Tumor nachweisen. Die Raumforderung wies jedoch ein deutlich inhomogens KM-Enhancement (Abbildung 3b) ohne signifikantes KM-Auswaschverhalten („Wash-out“) auf.
Neben den morphologischen gutartigen Tumorkriterien weisen die lipidreichen Nebennierenadenome in der MRT-Untersuchung in Fett-supprimierten Untersuchungssequenzen sowie speziellen doppelecho-Chemical-Shift-Messung, die „In-Phase und Gegenphase“ durchgeführt werden, ein typisches Signalverhalten auf. Diese MRT-Sequenzen erlauben eine quantitative Analyse, in denen sich Inzidentalome auf Grund des Signalverlustes bei der Fettunterdrückung sicher hypodens gegenüber anderen Nebennierenraumforderungen differenzieren lassen (8).
Nebennierenkarzinome sind unregelmäßig begrenzt und durch regressive Veränderungen (Nekrosen, Blutungen) inhomogen. Solide Tumoranteile zeigen eine deutliche KM-Aufnahme. Kleinere Karzinome können sich relativ homogen darstellen. In 30 Prozent der Fälle finden sich auch Kalzifikationen, die magnetresonanztomographisch schwierig zu diagnostizieren sind (9).
Der Verdacht auf einen bösartigen Tumor kann bei den folgenden radiologischen Eigenschaften gestellt werden: Irregularität, Inhomogenität, Verkalkungen, Größe > 4 cm im Durchschnitt, Unilateralität und > 20 Hounsfield-Units (HU) in der CT. Auch ein verzögertes Kontrastmittel-Washout von < 50 Prozent innerhalb von 10 min. nach der Applikation, eine hohe Aufnahme im FDG-PET sowie eine Lokalinfiltration, Lymphadenopathie oder Metastasen sind als suspekt anzusehen (5).
Zeitgleich zu der oben aufgeführten Bildgebung sollten klinische Untersuchung und Labordiagnostik angeschlossen werden (2). Für eine bessere Übersicht wird hier auf die unterschiedlichen Hormonstörungen einzeln eingegangen.
Laboruntersuchung
Ein Hypercortisolismus beruht in 80 Prozent der Fälle auf einer vermehrten ACTH-Produktion aufgrund eines Hypophysenadenoms, dem „Morbus Cushing“. Seltener gibt es sonstige ACTH-produzierende Tumore („ektopes Cushing-Syndrom“) oder ein „adrenales Cushing-Syndrom“ durch Nebennierentumore, die direkt Cortisol produzieren. Klassische Symptome sind Striae rubrae, Hämatome und „Pergamenthaut“, Akne, Hirsutismus, ein sekundärer arterieller Hypertonus oder eine proximale Myopathie (vor allem die Gesäß- und Oberschenkelmuskulatur betreffend, was zu erschwertem Treppensteigen und Gangunsicherheit führen kann). Außerdem können Stammfettsucht, Vollmondgesicht und Wundheilungsstörungen sowie Osteoporose, Depression, Stimmungslabilität und ein Diabetes mellitus die Folge sein (1).
Fällt der niedrig-dosierte Dexamethason-Test (1mg) mit Werten > 138 nmol/l aus, liegt eine autonome Cortisol-Sekretion vor. Dann sollten neben dem Plasma-ACTH auch ein 24-Stunden-Urin auf freies Cortisol untersucht werden (2). Eine klinische Relevanz leitet sich aus einer autonomen Cortisol-Sekretion jedoch nicht zwangsweise ab. Aber es sollte ein Screening auf arteriellen Hypertonus, Vorhofflimmern, Diabetes mellitus und weitere Komorbiditäten erfolgen (2, 4, 5, 6).
Differentialdiagnose
Das Phäochromozytom ist ein meist benigner Tumor des Nebennierenmarks, bei dem es zu einer vermehrten Produktion von Katecholaminen wie Adrenalin und Noradrenalin kommt. Selten kommt die extraadrenale Form vor, bei der die Überproduktion entlang des sympathischen Grenzstrangs stattfindet. Die häufigsten klinischen Entäußerungen sind arterieller Hypertonus, Kopfschmerzen, Schweißausbrüche, Palpitationen und Wärmeintoleranz (1).
Eine Laboruntersuchung mit der Fragestellung „Phäochromozytom“ sollte eine Bestimmung der Metanephrine im Plasma und im 24-Stunden-Sammelurin einschließen (3). Diese werden im Gegensatz zu Adrenalin, Noradrenalin und der Vanillinmandelsäure kontinuierlich sezerniert und haben daher auch eine längere Halbwertszeit. Es sollte auf definierte Abnahmebedingungen geachtet werden: 30 Minuten vor der Abnahme im stressfreien Zustand sollte eine Ruhezeit eingehalten werden (4).
Besteht der Verdacht auf ein extra-adrenales Phäochromozytom, können eine MIBG-Szintigrafie, ein kombiniertes DOPA-PET-CT oder ein FDG-PET-CT erfolgen. Da Phäochromozytome insgesamt zu fast einem Drittel genetisch bedingt sind, werden eine familiäre Beratung und eine genetische Testung immer empfohlen (1).
Einem Hyperaldosteronismus liegt entweder ein Adenom („Conn-Syndrom“) oder eine bilaterale Nebennieren-Hyperplasie (BNH) zugrunde. Es wird geschätzt, dass bei circa einem Drittel der Patienten, die in einer Hypertonie-Ambulanz behandelt werden und deren Blutdruck nicht medikamentös einzustellen ist, ein Hyperaldosteronismus zugrunde liegt. Eine Hypokaliämie kann ein Hinweis sein, muss aber obligatorisch nicht vorliegen (1).
Drei Wochen vor Bestimmung des Aldosteron/Renin-Quotienten sollten Antihypertonika wie Spironolacton, ACE-Hemmern, Sartane und Betablocker abgesetzt werden (1, 3, 4). Bei uneindeutiger Bildgebung zur Seitenzuordnung kann eine seitengetrennte Blutentnahme per Nebennieren-Venenkatheterisierung oder eine Nebennieren-Szintigraphie erfolgen (1, 4).
Tumore der Nebenniere, die vor allem Sexualhormone produzieren, sind häufig maligne. Meist finden sich erhöhte Steroidhormonvorstufen wie DHEA und 11-Deoxycortisol (4).
Das Adrenokortikale Karzinom (ACC) ist extrem selten. In Deutschland werden jährlich 1-2 Neuerkrankungen pro 100.000 Einwohner gezählt. Es gibt zwei Altersgipfel: Kinder unter 5 Jahren und Erwachsene zwischen 40 - 50 Jahren, wobei letztere meist aggressiver sind. Frauen sind mit einem Verhältnis von 1,5 zu 1 häufiger als Männer betroffen. Neben abdominellen Schmerzen und einem Völlegefühl können auch Symptome durch eine vermehrte Hormonproduktion herausstechen. Oben aufgeführte Zeichen eines Hypercortisolismus sind häufig, zudem in bis 60 Prozent eine Virilisierung oder beispielsweise eine Gynäkomastie. Die Kombination aus Androgen- und Cortisolüberschuss ist typisch für das ACC (1, 3, 4).
Es sollte die laborchemische Diagnostik wie bei jedem Inzidentalom erfolgen. Außerdem eine CT oder MRT des Abdomens mit Kontrastmittel, eine CT des Thorax und gegebenenfalls eine Skelett-Szintigraphie. Eine Feinnadelaspiration (FNA) sollte nur in absoluten Ausnahmefällen stattfinden, da die Dignität meist histopathologisch nicht bestimmbar ist und lediglich eine Aussage darüber getroffen werden kann, ob es sich um ein ACC oder eine Metastase eines anderen Primarius handelt. Nur wenn ein extraadrenales Malignom bekannt ist, es eine bildmorphologisch suspekte adrenale Raumforderung ohne Hormonexzess gibt und eine klinische Relevanz gibt, sollte eine FNA erwogen werden (2, 4).
Ist ein extraadrenales Malignom bekannt, sind dennoch 48 Prozent der Raumforderungen der Nebenniere benigne. Nebennierenmetastasen werden besonders häufig beim Mamma-CA und dem NSLCL (dann häufig bilateral) gesehen, seltener bei Melanomen, dem HCC oder NCC (4).
Therapie
Grundsätzlich wurde die Empfehlung ausgesprochen, Tumore mit einer Größe > 6 cm Durchmesser wegen eines steigenden Malignitätsrisikos operativ zu entfernen. Besteht ein Größendurchmesser von 4 - 6 cm sollte eine Operationsindikation individuell getroffen werden. Ohne einen Hinweis auf Malignität sollten Inzidentalome kleiner als 4 cm Durchmesser nicht operativ entfernt werden. Ein operativer Eingriff sollte immer mit dem Ziel des adrenokortikalen Funktionserhalts vorgenommen werden. Hierfür muss mindestens 1/3 der Nebenniere erhalten bleiben. Nach bilateraler Adrenalektomie liegt das Risiko für eine schwere Addison-Krise bei circa 20 Prozent (4).
Ein bis zwei Wochen vor der operativen Entfernung eines Phäochromozytoms sollte das Antihypertensivum Phenoxybenzamin, ein Alphablocker mit peripher vasodilatierender Wirkung eindosiert werden (1).
Beim unilateral hervorgerufenen Hyperaldosteronismus kann eine Blutdrucknormalisierung in bis zu 50 Prozent der Fälle erreicht werden. Alternativ kann eine lebenslange Einnahme von Spironolacton erwogen werden. Eine Therapieoption der BNH ist eine Radiofrequenzablation (1, 4).
Sexualhormonproduzierende Tumore stellen immer eine OP-Indikation dar, es sollte zusätzlich eine lokoregionäre Lymphadenektomie erfolgen (4).
Der Karzinom-Verdacht macht eine offene en bloc Adrenalektomie ohne Kapseleröffnung mit lokoregionärer Lymphadenektomie in einem darauf spezialisierten Zentrum notwendig. Individuell sollte entschieden werden, wenn eine metastasierte Situation besteht. Bei positivem Resektionsrand sollte adjuvant eine Mitotane-Therapie und gegebenenfalls eine Radiotherapie erfolgen. Ist das Karzinom primär irresektabel können in Kombination Mitotane, Etopsosid, Doxorubicin und Cisplatin verabreicht werden. Postoperativ sollte eine konsequente Glukocorticoid-Substitution und gegebenenfalls ebenfalls eine Mineralokortikoide, erfolgen. In den ersten zwei Jahren nach OP sollte alle drei Monate eine CT Thorax und Abdomen sowie eine endokrinologische Vorstellung zur Nachkontrolle erfolgen. Die 5-JÜR im frühen Stadium I wird mit 82 Prozent , im IV. Stadium mit 13 Prozent angegeben (4).
Verlauf der Patientin in der vorliegenden Kasuistik
Letztlich wurde nach dem Zufallsbefund eines suspekten Nebennierentumors bei der Patientin ein viszeralchirurgisches Konsil gestellt und, auch zur OP-Planung, eine MRT des Abdomens angeschlossen. Die operative Resektion wurde binnen einer Woche angestrebt. Unter perioperativer Addison-Prophylaxe erfolgte eine linksseitige Adrenalektomie inklusive Splenektomie und Lymphadenektomie, worauf ein kurzfristiger Aufenthalt auf der Intensivstation folgte. Der histopathologische Befund ergab den Nachweis eines Nebennierenrindenkarzinoms mit zwei Lymphknotenmetastasen (2/2) ohne extrakapsuläre Extension. TNM: pT1, pN1 (2/2, ece-), R0, L0, V0, Pn0.
Zusammenfassung
Zusammenfassend muss konstatiert werden, dass die Gangunsicherheit und die Stürze der Patientin multifaktoriell bei subkortikaler arteriosklerotischer Encephalopathie (SAE, Abbildung 2) und bei steroid-induzierte Myopathie der proximalen Muskulatur bei Cushing-Syndrom bedingt sind. Dies erklärt auch, warum der Patientin insbesondere das Treppensteigen schwerfiel. Bei der Abklärung von Gangstörungen und Stürzen im Alter sollten auch seltene Komorbiditäten mit bedacht werden.
Literatur
- Deutsche Gesellschaft für Endokrinologie
https://www.endokrinologie.net/krankheiten-nebennierentumor.php - Erste Europäische Leitlinie zum Nebennieren-Inzidentalom, Bayerisches Ärzteblatt 4/2017, S.144.148
https://www.bayerisches-aerzteblatt.de/fileadmin/aerzteblatt/ausgaben/2017/04/einzelpdf/BAB_4_2017_144_148.pdf - „Clinical presentation and evaluation of adrenocortical tumors -UpToDate“ A Lacroix, L K Niemann, K A Martin
- S2k-Leitlinie, Operative Therapie von Nebennierentumoren, AWMF-Registernummer 088-008, Version vom 17. Dezember 2017
https://www.awmf.org/uploads/tx_szleitlinien/088-008l_S2k_Operative-Therapie_Nebennierentumoren_2019-07.pdf - „Evaluation and management of the adrenal incidentaloma“, W F Young, L K Niemann, S E Carty, K A Martin, W Chen
- Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guideline in collaboration with the European Network for the Study of Adrenal Tumors von M. Fassnacht et al., Eur J Endocrinol; 2016 Aug;175(2):G1-G34 https://pubmed.ncbi.nlm.nih.gov/27390021/
- Duale Reihe Radiologie. Reiser M, Kuhn F, Debus J, Hrsg. 4., vollständig überarbeitete Auflage. Stuttgart: Thieme; 2017.
- Ganzkörper-MR-Tomographie. Rummeny E, Reimer P, Heindel W, Hrsg. 2., vollständig überarbeitete und erweiterte Auflage. Stuttgart: Thieme; 2006
- Ganzkörper-MR-Tomographie. Rummeny E, Reimer P, Heindel W, Hrsg. 2., vollständig überarbeitete und erweiterte Auflage. Stuttgart: Thieme; 2006.