Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik: Unklare Anämie eines 50 Jahre alten Mannes
Folge 79 der Reihe Zertifizierte Kasuistik
von Moritz Kleemiß, Peter Brossart
Fallauflösung
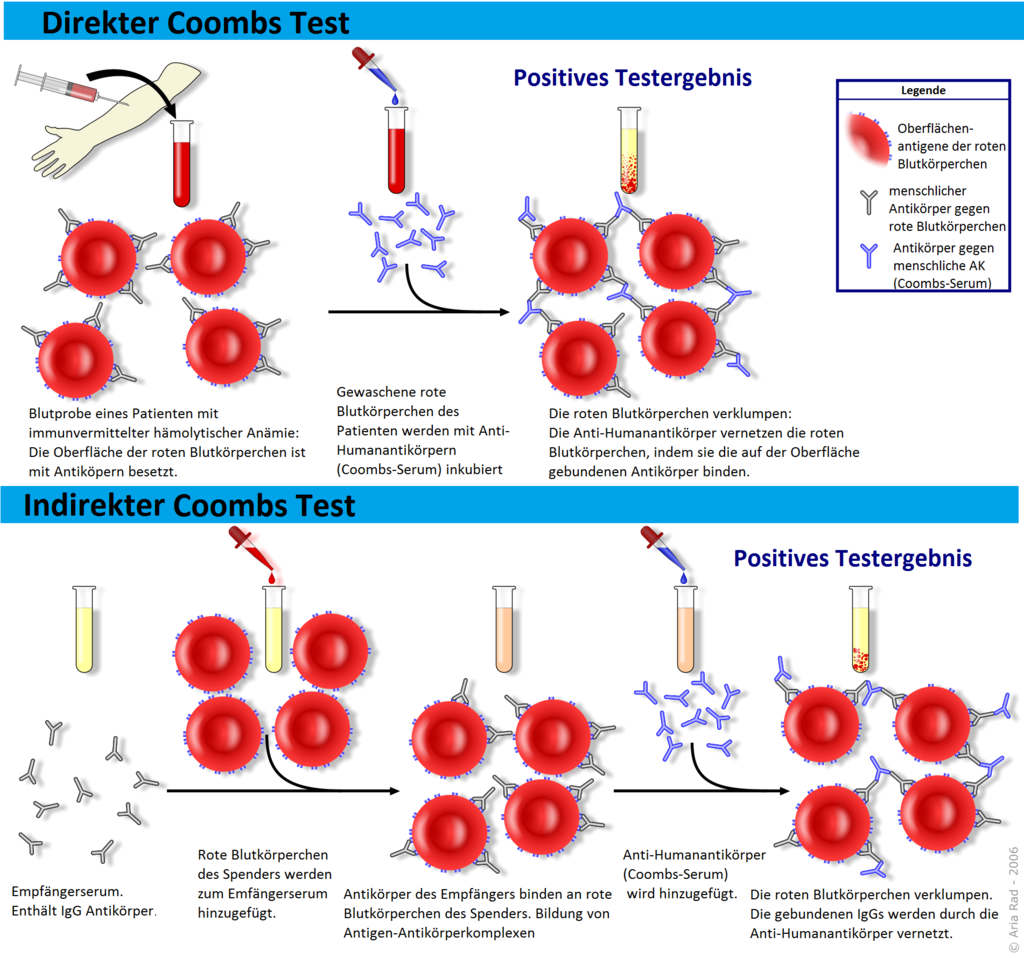
Als Ursache der Belastungsdyspnoe des Patienten bestätigte sich auch in unseren Laboruntersuchungen eine schwere normochrome, normozytäre Anämie. Durch einen Coombs-Test konnten freie und gebundene Wärmeautoantikörper der Klasse IgG nachgewiesen werden.
In Zusammenschau mit passend veränderten Hämolyseparametern (erhöhtes indirektes Bilirubin, erhöhte LDH und vermindertes Haptoglobin) stellten wir die Diagnose einer Autoimmunhämolytischen Anämie vom Wärmetyp (wAIHA). Wir initiierten eine immunsuppressive Therapie mit Prednisolon 1 mg/kg KG, die bei hierunter ausbleibender Besserung im Verlauf auf 2 mg/kg KG gesteigert wurde. Zur weiterhin symptomatischen und unveränderten Anämie zeigte sich eine zusätzliche Thrombozytopenie (bis minimal 43 G/l), sodass die Diagnose eines Evans-Syndrom gestellt wurde. Ein Evans-Syndrom stellt die Kombination aus AIHA und Immunthrombozytopenie dar.
Um eine sekundäre Genese des Evans-Syndrom auszuschließen, erfolgten eine Computertomographie von Hals, Thorax und Abdomen sowie eine Knochenmarkpunktion, in der sich eine trilineär ausreifende Hämatopoese ohne Malignominfiltration darstellte. In der CT sahen wir eine ausgeprägte Splenomegalie mit 19 cm im Querdurchmesser.
Unter der erhöhten Prednisolon-Dosis besserte sich die Anämie nicht. Aufgrund der symptomatischen Belastung des Patienten erfolgten wiederholte Transfusionen von Erythrozytenkonzentraten, die nur kurzfristige Besserung der Symptomatik und Anstiege des Hämoglobin-Werts erzielten.
Die immunsuppressive Therapie wurde mit der Gabe des CD20-Antikörpers Rituximab eskaliert. Es erfolgten vier Gaben im wöchentlichen Abstand. Da auch unter dieser Therapie keine Besserung der Anämie und der Thrombozytopenie zu messen waren, wiederholten wir die Knochenmarkpunktion und die initial erfolgte "Umfelddiagnostik". Wiederum ließ sich keine Ursache der wAIHA detektieren.
Nach Etablierung eines EK-Transfusionsschemas und unter zusätzlich begonnener immunsuppressiver Therapie mit Azathioprin, wurde der Patient schließlich und immer noch deutlich symptomatisch in die ambulante Behandlung entlassen.
In der hier durchgeführten Diagnostik fielen nun serologisch ein fast vollständiges Fehlen von IgG und eine Verminderung der Immunglobuline IgA und IgM auf, sodass wir die Verdachtsdiagnose eines primären Antikörpermangelsyndroms stellten. Die zur Bestätigung dieses Verdachts sinnvolle Testung einer fehlenden oder unzureichenden Impfantwort konnte aufgrund der erfolgten CD20-Antikörper-Gabe und der Akuität der klinischen Situation nicht erfolgen.
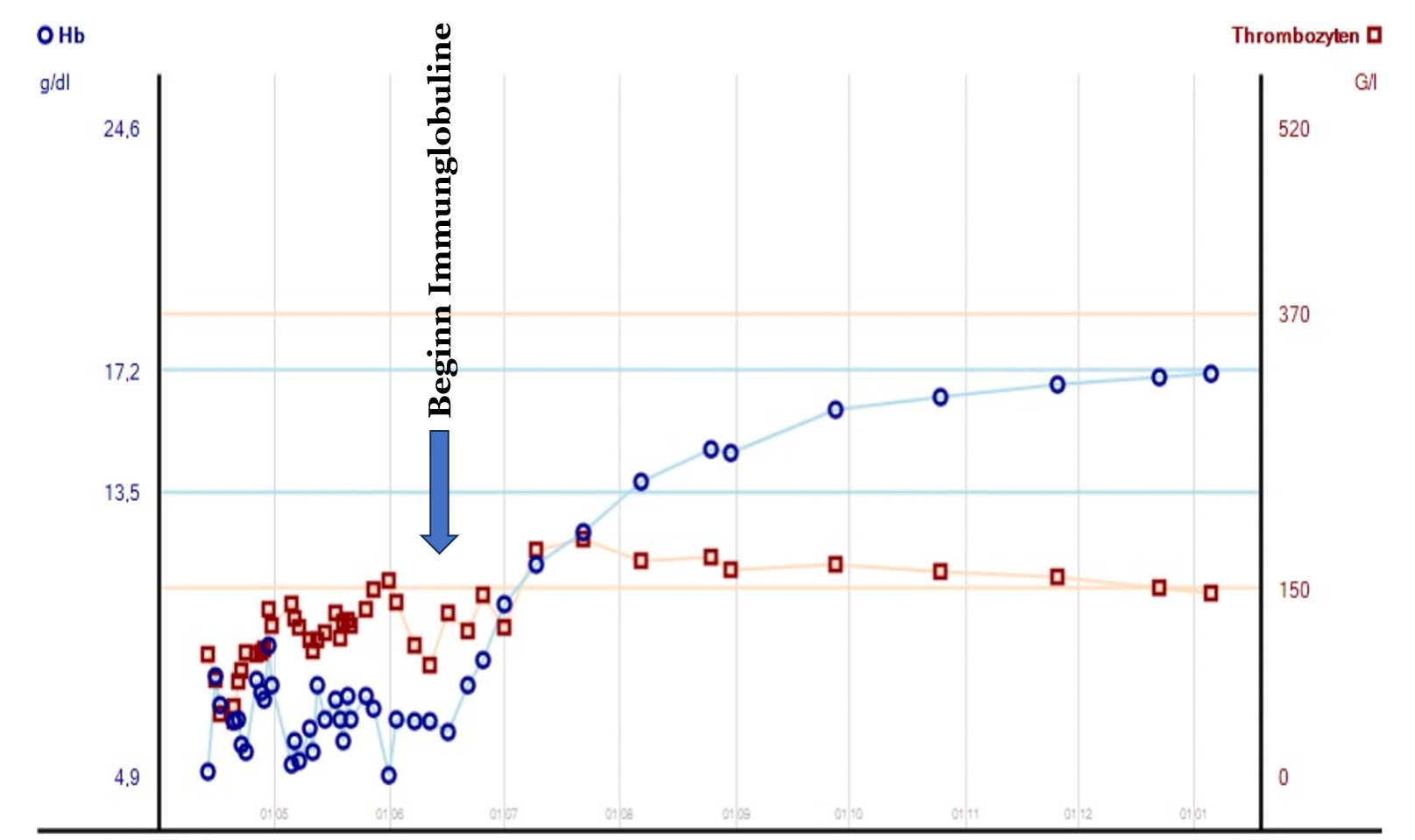
Mit der Diagnose eines primären Antikörpermangelsyndroms begannen wir eine intravenöse Immunglobulin-Substitution mit 0,4 g Immunglobuline/kg Körpergewicht, die von dem Patienten gut vertragen wurden. Bereits in der ersten Laborkontrolle eine Woche nach Etablierung der Immunglobulin-Substitution war ein Anstieg der Retikulozyten, des Hämoglobins und der Thrombozyten zu messen. Unter der fortgesetzten Therapie kam es schließlich zu einer vollständigen Normalisierung des Blutbildes und konsekutiv zu einer Wiederherstellung der altersgemäßen Belastbarkeit des Patienten. Als Ursache der AIHA und der ITP diagnostizierten wir bei dem 50-jährigen Patienten eine Common Variable Immunodeficiency.
Unter der - bis heute - fortgesetzten Immunglobulin-Substitution kam es weder zu neuerlichen Immunzytopenien noch zu Infektionskomplikationen.
Epidemiologie und Diagnostik der AIHA
Die Autoimmunhämolytische Anämie mit Nachweis von Wärme-Autoantikörpern (wAIHA) ist die häufigste Form der autoimmunhämolytischen Anämie. Mit einer geschätzten Inzidenz von 1 - 3 Fällen je 100.000 / Jahr ist sie jedoch eine seltene Erkrankung [1]. Zwar tritt die wAIHA in den meisten Fällen idiopathisch auf, jedoch können eine Vielzahl von Erkrankungen eine sekundäre wAIHA verursachen. In 5 - 20 Prozent der Fälle ist eine CLL oder ein anderes Non-Hodgkin-Lymphom ursächlich[2].
Weitere Ursachen können primäre Immundefekte (vor allem CVID und ALPS), Autoimmunerkrankungen (vor allem Systemischer Lupus erythematodes), Infektionen und Medikamente sein[2]. Genetische Risikofaktoren, die vor allem die variablen Regionen der Immunglobulin-Schwerketten- und Leichtkettenloci betreffen, sind beschrieben.
Pathomechanistisch liegen der autoimmunhämolytischen Anämie gegen Erythrozyten gerichtete Autoantikörper zugrunde[3]. Bei Wärmeautoantikörpern handelt es sich um IgG-Antikörper mit einer fakultativen Komplementaktivierung, wohingegen bei Kälteautoantikörpern meist IgM-Antikörper mit einer zusätzlichen Komplementaktivierung nachgewiesen werden können.
Die Diagnose einer autoimmunhämolytischen Anämie erfolgt über den Coombs-Test. Hiermit können an Erythrozyten gebundene Antikörper und eine zusätzliche Komplementaktivierung nachgewiesen und identifiziert werden. In 60-70 Prozent der Fälle finden sich bei der AIHA Wärmeautoantikörper, in 20 - 30 Prozent Kälteantikörper[2].
In den übrigen Fällen liegen Mischtypen mit gehäuft schweren Verläufen oder seltene Erkrankung vor (z.B. Donath-Landsteiner Kälteantikörper). Die Spezifität des Coombs-Tests ist hoch; für einen positiven Coombs-Test ist die Bindung von rund 500 Antikörpern je roter Blutzelle notwendig. Andere Methoden mit höherer Sensitivität wie der Mikrosäulenagglutinations-Test können bei Coombs-Test-negativen AIHA zur Diagnosestellung beitragen[2].
Das klinische Bild der Autoimmunhämolytischen Anämie ist heterogen. Es wird beeinflusst durch die Affinität, Pathogenität und die thermale Amplitude des bindenden Autoantikörpers. Zusätzlich spielt die Aktivität des retikulo-endothelialen Systems und die Fähigkeit der Hämatopoese zur kompensatorischen Steigerung der Blutbildung eine entscheidende Rolle.
Risikofaktoren für einen schweren oder rezidivierenden Verlauf sind eine ausgeprägte Anämie bei Erstdiagnose (< 6 g/dl), ein non-wAIHA-Typ und das Vorliegen eines Evans-Syndrom[2].
Die Symptomatik des Patienten wird bestimmt durch den Schweregrad der Anämie, beziehungsweise die Symptome einer verursachenden Erkrankung. Bei Erstdiagnose einer AIHA sollte durch die Eigen- und Familienanamnese eine mögliche sekundäre Genese der AIHA aufgedeckt werden. Eine Knochenmarkpunktion zur Detektion einer zugrundeliegenden hämatologischen Erkrankung und zur Einschätzung der hämatopoetischen Funktion sollte spätestens im Falle eines ersten Rezidivs erfolgen, kann aber auch bei Erstdiagnose schon sinnvoll sein[4].
Therapie der AIHA mit Wärme-Autoantikörpern
Die Therapie der wAIHA richtet sich nach dem Schweregrad und der Akuität der Erkrankung. Bei akutem Beginn und hämodynamischer Instabilität sollte eine immunsuppressive Therapie mit Methylprednisolon mit 100 - 200 mg/d für 7 - 10 Tage unverzüglich eingeleitet werden. In allen anderen Fällen erfolgt die Primärtherapie mit Prednisolon 1 - 1,5 mg/Kg KG für 3 - 4 Wochen[5]. In Fällen, in denen sich eine sekundäre wAIHA hat detektieren lassen, kommt der Therapie der Primärerkrankung eine entscheidende Bedeutung zu (bei der CLL findet sich in 5 - 10 % der Fälle eine assoziierte AIHA)[5].
In schweren Fällen sollte die zusätzliche Gabe von intravenösen Immunglobulinen 0,4 g/kg/d erwogen werden, deren Wirkeintritt rascher ist (nach rund 1 - 5 Tagen) als bei der Prednisolon-Therapie (nach rund 7 - 25 Tagen)[5].
Wie oben erwähnt, sollte bei fehlender Besserung der Anämie spätestens jetzt eine Knochenmarkpunktion und weitere Diagnostik erfolgen.
War historisch die Splenektomie bei fehlendem Ansprechen auf Glucocorticoide die Therapie der zweiten Wahl, rücken nun zunehmend andere und zielgerichtete Therapien in den Vordergrund. Als Standardtherapie in der zweiten Therapieline erfolgt der Einsatz des CD20-Antikörpers Rituximab in einer Dosierung von 375mg/m² weekly für vier Wochen[6]. Hierbei sollte bedacht werden, dass die Wirkung erst nach 3 - 6 Wochen zu erwarten ist. Kleinere Fallserien beschreiben auch die Wirksamkeit von Chemoimmuntherapien in dieser Situation.
Analog zur ITP kann die Anwendung von Erythropoetin sinnvoll sein, und die Bestimmung des endogenen Erythropoetin-Spiegels sollte erfolgen[7].
In Fallserien sind mittlerweile eine Vielzahl von neuen, zielgerichteten Substanzen mit guter Wirksamkeit bei der wAIHA beschrieben, wie zum Beispiel Ibrutinib, Fostamatinib und Pegcetacoplan, die meist den B-Zell-Rezeptor-Signalweg oder die Komplementaktivierung inhibieren. Klinische Studien zur Etablierung dieser Medikamente in der Therapie der wAIHA laufen aktuell[5].
Diagnostik und Therapie der Common Variable Immunodeficiency
In der oben beschriebenen Kasuistik hatte sich ein primäres Immundefektsyndrom (PID), im Speziellen eine Common Variable immundeficiency (CVID) als Ursache der wAIHA diagnostizieren lassen.
Eine Vielzahl von primären Immundefekten können anhand des Phänotyps und teilweise zugrundeliegender genotypischer Veränderungen unterschieden werden[8].
Antikörpermangelerkrankungen sind die häufigsten Formen der PID (30 - 70 %). In dieser Gruppe stellt die CVID die häufigste Erkrankung dar (40,2 % aller PID-Patienten in den USA)[9].
Die CVID ist eine heterogene Erkrankung, deren Diagnosestellung herausfordernd sein kann. Die Latenz zwischen erstem Symptom und Erstdiagnose beträgt durchschnittlich 5 - 9 Jahre[10]. Eine monogene Ursache findet sich nur in 20 Prozent der betroffenen Patienten, sodass die Diagnose auf klinischen und laborchemischen Kriterien fußt. Symptome, die den Verdacht auf eine CVID lenken können, sind: erhöhte Infektanfälligkeit, autoimmune Manifestationen (und hier vor allem Immunzytopenien), granulomatöse Erkrankungen, polyklonale Lymphoproliferation und Familienmitglieder mit Antikörpermangelerkrankung.
Neben dem Vorhandensein dieser klinischen Symptome müssen obligat eine Verminderung von IgG und IgA (vermindert um mehr als zwei Standardabweichungen) und gegebenenfalls zusätzlich von IgM vorliegen. Als weiteres Diagnosekriterium ist eine fehlende oder verminderte Impfantwort oder verringerte switched-memory B-Zellen gefordert[11].
Das Alter bei Erstdiagnose variiert stark. Patientenfälle, die im 7. Lebensjahrzehnt diagnostiziert wurden, sind beschrieben[12]. Im Vordergrund des klinischen Bildes stehen Infektionen vor allem des respiratorischen Systems und des Gastrointestinaltraktes. Autoimmunität ist häufig (21 - 42 %) und tritt vor allem in Form von Autoimmunzytopenien auf. Patienten mit CVID haben ein erhöhtes Risiko für maligne Erkrankungen (vor allem B-Zell-Non-Hodgkin-Lymphome und Magenkarzinome)[9].
Enteropathien mit Malnutrition und Gewichtsverlust sowie allergische Erkrankungen treten bei CVID-Patienten auf.
Da eine Hypogammaglobulinämie die wesentliche Grundlage der CVID bildet, ist die Antikörpersubstitutionstherapie die Basis der Behandlung. Die Therapie kann intravenös oder subkutan und damit durch den Patienten auch im Selbstmanagement erfolgen. Die Anfangsdosis sollte bei 0,4 g polyvalente Immunglobuline/kg KG/Monat liegen und ein IgG-Talspiegel von 4,5 g/l nicht unterschritten werden[13].
Sollte es unter Antikörpersubstitutionstherapie zu Infektionen kommen, ist der zügige Einsatz von Breitbandantibiotika sinnvoll. Im Fall von Infektionen sollte eine Erregerbestimmung versucht werden. Zu bedenken ist, dass serologische Untersuchungen bei Antikörpermangelerkrankungen keinen Nutzen haben.
Patienten mit CVID sollten alle von der STIKO empfohlenen Schutzimpfungen erhalten. Der Einsatz von Lebendimpfungen soll nicht erfolgen[12].
Literatur
- Gehrs B and Friedberg R (2002) Autoimmune Hemolytic Anemia American Journal ofHematology 69:258±271 (2002)
- Barcellini W and Fattizzo B (2020) The Changing Landscape of Autoimmune Hemolytic Anemia. Front. Immunol. 11:946.doi: 10.3389/fimmu.2020.00946
- Barcellini W. New insights in the pathogenesis of autoimmune hemolytic anemia. Transfus Med Hemother. (2015) 42:287–93. doi: 10.1159/000439002
- Barcellini W, Giannotta J, Fattizzo B. Autoimmune hemolytic anemia in adults: primary risk factors and diagnostic procedures. Expert Rev Hematol. 2020;13(6): 585-597.
- Barcellini W, Fattizzo B. How I treat warm autoimmune hemolytic anemia. Blood. 2021 Mar 11;137(10):1283-1294. doi: 10.1182/blood.2019003808. Erratum in: Blood. 2023 Jan 26;141(4):438-439. PMID: 33512406
- Narat S, Gandla J, Hoffbrand AV, Hughes RG, Mehta AB. Rituximab in the treatment of refractory autoimmune cytopenias in adults. Haematologica. 2005 Sep;90(9):1273-4. PMID: 16154853.
- Fattizzo B, Michel M, Zaninoni A, et al. Efficacy of recombinant erythropoietin in autoimmune haemolytic anaemia: a multicentre internationalnn study [published online ahead of print 30 April 2020]. Haematologica. doi:10.3324/haematol.2020.250522.
- Bousfiha A, Moundir A, Tangye SG, Picard C, Jeddane L, Al-Herz W, Rundles CC, Franco JL, Holland SM, Klein C, Morio T, Oksenhendler E, Puel A, Puck J, Seppänen MRJ, Somech R, Su HC, Sullivan KE, Torgerson TR, Meyts I. The 2022 Update of IUIS Phenotypical Classification for Human Inborn Errors of Immunity. J Clin Immunol. 2022 Oct;42(7):1508-1520. doi: 10.1007/s10875-022-01352-z. Epub 2022 Oct 6. PMID: 36198931.
- Yazdani R, Habibi S, Sharifi L, Azizi G, Abolhassani H, Olbrich P, Aghamohammadi A. Common Variable Immunodeficiency: Epidemiology, Pathogenesis, Clinical Manifestations, Diagnosis, Classification, and Management. J Investig Allergol Clin Immunol. 2020;30(1):14-34. doi: 10.18176/jiaci.0388. Epub 2019 Feb 11. PMID: 30741636.
- Slade CA, Bosco JJ, Binh Giang T, Kruse E, Stirling RG, Cameron PU,Hore-Lacy F, Sutherland MF, Barnes SL, Holdsworth S, Ojaimi S, Unglik GA, De Luca J, Patel M, McComish J, Spriggs K, Tran Y, Auyeung P, Nicholls K, O’Hehir RE, Hodgkin PD, Douglass JA, Bryant VL and van Zelm MC (2018) Delayed Diagnosis and Complications of Predominantly Antibody Deficiencies in a Cohort of Australian Adults. Front. Immunol. 9:694. doi: 10.3389/fimmu.2018.00694
- Seidel MG, Kindle G, Gathmann B, Quinti I, Buckland M, van Montfrans J, Scheible R, Rusch S, Gasteiger LM, Grimbacher B, Mahlaoui N, Ehl S; ESID Registry Working Party and collaborators. The European Society for Immunodeficiencies (ESID) Registry Working Definitions for the Clinical Diagnosis of Inborn Errors of Immunity. J Allergy Clin Immunol Pract. 2019 Jul-Aug;7(6):1763-1770. doi: 10.1016/j.jaip.2019.02.004. Epub 2019 Feb 15. PMID: 30776527.
- Wehr C, Kivioja T, Schmitt C, Ferry B, Witte T, Eren E, et al. The EUROclass Trial: Defining Subgroups in Common Variable Immunodeficiency. Blood (2008) 111(1):77–85. doi: 10.1182/blood-2007-06-091744
- Krudewig J et al; Arbeitsgemeinschaft Pädiatrische Immunologie e. V. (API). Interdisziplinäre AWMF-Leitlinie zur Therapie primärer Antikörpermangelerkrankungen [Interdisciplinary AWMF guideline for the treatment of primary antibody deficiencies]. Klin Padiatr. 2012 Oct;224(6):404-15. German. doi: 10.1055/s-0032-1323837. Epub 2012 Nov 9. PMID: 23143768.