Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik "Patientin mit Hyperandrogenämie"
wissenschaftlich begutachtet durch Professor Dr. Malte Ludwig, Chefarzt der Abteilung Angiologie und Phlebologie der Interne Klinik Dr. Argirov, Berg.
von Dr. Benjamin Rösing, Professor Dr. Katrin van der Ven, Priv.-Doz. Dr. Christoph Dorn, Professor Dr. Hans Schild
Inhalt
Physiologie der weiblichen Androgenproduktion
Pathophysiologie der Hyperandrogenämie
- PCOS
- Late onset AGS
- Ovarialtumor und NNR Tumor
Physiologie der weiblichen Androgenproduktion
Die Androgenproduktion bei Frauen findet sowohl in der Nebennierenrinde (NNR), als auch im Ovar statt. Die Hormonproduktion unterliegt tageszeitlichen (NNR) und zyklusabhängigen (Ovar) Schwankungen die im Bereich von 15 – 30 Prozent liegen.
Die Steuerung erfolgt durch die Ausschüttung luteinisierenden Hormons (LH) und adreno-corticotrophen Hormons (ACTH) aus der Hypophyse. Die Bezeichnung Androgene bezieht sich auf die Gruppe der Sexualhormone mit 19 Kohlenstoffatomen (C-19 Steroide).
Dazu zählen
- Dehydroepiandrosteron (DHEA) und dessen sulfatierte Form (DHEAS),
- Androstendion (AD),
- Testosteron (T) und
- Dihydrotestosteron (DHT).
Die C-19 Steroide stellen den größten Anteil der zirkulierenden Sexualhormone. Das im Serum bestimmbare Testosteron stammt zu etwa je 25 Prozent direkt aus dem Ovar und der NNR. Die verbleibenden 50 Prozent des Serum Testosterons stammen aus den ovariellen (AD, DHEA) und den adrenalen (AD, DHEA, DHEAS) Präkursoren. AD wird wie T etwa zur Hälfte im Ovar und in der NNR produziert. Für DHEA liegt der adrenale Anteil bei etwa 65 Prozent und für DHEAS bei über 95 Prozent. Die angegebenen Verteilungen beziehen sich auf die im Serum messbaren Werte.
Der Metabolismus im Gewebe ist deutlich weniger gut bekannt, aber möglicherweise der bedeutendere Vorgang im Bezug auf die Wirkung im Endorgan und wird am stärksten durch DHT vermittelt. Die biologische Wirkung der Androgene hängt von der Bioverfügbarkeit sowie der jeweiligen androgenen Potenz der einzelnen Steroide und von der Bindung und Signalübertragung durch den Testosteronrezeptor im Zielgewebe ab. Testosteron wird an sexualhormonbindendes Globulin SHBG gebunden. Dadurch verringert sich die freie Testosteronkonzentration. Deren einheitenlose Größe ist der freie Androgenindex (FAI, 100X T / SHBG). Testosteronrezeptoren sind zum Beispiel in der Haut und an Hautanhangsorganen, in der Brust, im Endometrium, am Knochengewebe und im Zentralnervensystem zu finden.
Pathophysiologie der Hyperandrogenämie
Im Folgenden werden hyperandrogenämische Störungen bei prämenopausalen Frauen beschrieben.
PCOS
Das Syndrom der polycystischen Ovarien (PCOS) wird nach den „Rotterdam Kriterien“ (Konsensuskonferenz ESHRE / ASRM 2003) diagnostiziert, wenn mindesten zwei der folgenden drei Abweichungen vorliegen.
- Zyklusstörungen mit Oligo- oder Anovulation
- klinische und/oder laborchemisch diagnostizierte Hyperandrogenämie
- polycystische Ovarien
Beim PCOS treten außerdem häufig erhöhte LH Werte und ein LH/FSH Quotient > 2 auf. Der bei anovulatorischen Zyklen auftretende Gestagenmangel kann bei gleichzeitiger tonischer Estrogenproduktion zu einer Endometriumhyperplasie führen.
Late onset AGS
Das nicht klassische Adreogenitale Syndrom (AGS), auch als late onset AGS bezeichnet, beruht auf einem genetischen Enzymdefekt der Cortisol-Biosynthese (meist ist die 21-Hydroxylase betroffen, seltener die 11ß-Hydroxylase oder die 3ß-Hydroxysteroid Dehydrogenase). Durch die verminderte Cortisolsynthese und einem Anstieg des Präkursors 17 Hydroxyprogesteron (17-OHP) resultiert eine vermehrte Androgenproduktion.
Ovarialtumor und NNR Tumor
Bei einer Virilisierung, die sich sehr schnell entwickelt und bei stark erhöhten Androgenen (4-fach über der Norm), muss ein androgen-produzierender Tumor ausgeschlossen werden.
Klinik
Klinisch manifestieren sich erhöhte Androgenspiegel bei Frauen als Akne und Seborrhoe, Hirsutismus und Alopezie, in hohen Konzentrationen mit Veränderungen am Genitale (Klitorishypertrophie) und der Stimme. Am Haarfollikel der Kopfhaut führen Androgene zu einem Ersatz des pigmentierten Terminalhaares durch Vellusbehaarung. In allen anderen Körperregionen kommt es jedoch zur Umwandlung von Vellus- in Terminalbehaarung. Als Hirsutismus wird bei Frauen das Auftreten von Terminalbehaarung mit „männlichem Verteilungsmuster“ bezeichnet, also an Stellen, an denen normalerweise Vellusbehaarung zu finden ist.
Unterschiedliche Hautareale reagieren unterschiedlich empfindlich auf den Anstieg der Androgene: am empfindlichsten ist die Haut perimamillär, gefolgt von der Abdominalhaut im Bereich der Linea alba, des Gesichts, der Brust und der Oberschenkel. Die Klassifizierung des Hirsutismus nach Ferriman und Gallway berücksichtigt die unterschiedliche Lokalisation und erlaubt eine Verlaufskontrolle. Die ersten Anzeichen einer erhöhten Androgenaktivität treten meist während der Pubertät auf und bedeuten für die Betroffene häufig ein relevantes kosmetisches Problem. Häufig tritt zusätzlich eine Ovarialinsuffizienz auf.
Bei sehr ausgeprägter Androgenwirkung kommt es zur Virilisierung mit Klitorishypertrophie und irreversibler Stimmveränderung. Androgenproduzierende Tumoren führen typischerweise zu einem sehr schnellen Anstieg mit hohen Androgenwerten und rascher Entwicklung der klinischen Symptomatik.
Diagnostik
Die Diagnose der Hyperandrogenämie beruht auf der exakten Erfassung der Anamnese, der klinischen Symptomatik und auf der Bestimmung der entsprechenden Hormone im Plasma. Charakteristisch für die Hyperandrogenämie sind die Erhöhung von DHEAS als Marker für die Androgensekretion der Nebennierenrinde und Testosteron als ovariellem und adrenalem Androgen sowie die erniedrigten Werte von SHBG, dessen Synthese in der Leber durch Androgene gehemmt wird.
Im ACTH Test wird die 17-OHP Synthese forciert und ein starker Anstieg ist diagnostisch verwertbar. Bei pathologischem Anstieg des 17-OHP sollte eine molekulargenetische Untersuchung zur Überprüfung auf Vorliegen eines late onset AGS durchgeführt werden, das typischerweise mit einem genetischen Defekt der 21-Hydroxylase einhergeht.
Außerdem müssen als bildgebende Untersuchungen zunächst der Ultraschall der Ovarien und bei sehr hohen Androgenwerten mit Tumorverdacht und unauffälliger Vaginalsonographie ein MRT der NNR erfolgen. Wie im hier berichteten Fall sollte eine selektive Katheteruntersuchung durchgeführt werden, wenn oben genannte bildgebende Verfahren keine Klärung bieten. Dabei wird ein Katheter über die Vena Iliaca und die Vena cava zu den jeweiligen venösen Abflüssen der Nebennieren und der Ovarien geführt, um Hormonserumbestimmungen im Abstromgebiet des jeweiligen Organs selektiv durchzuführen.
Abbildung 1
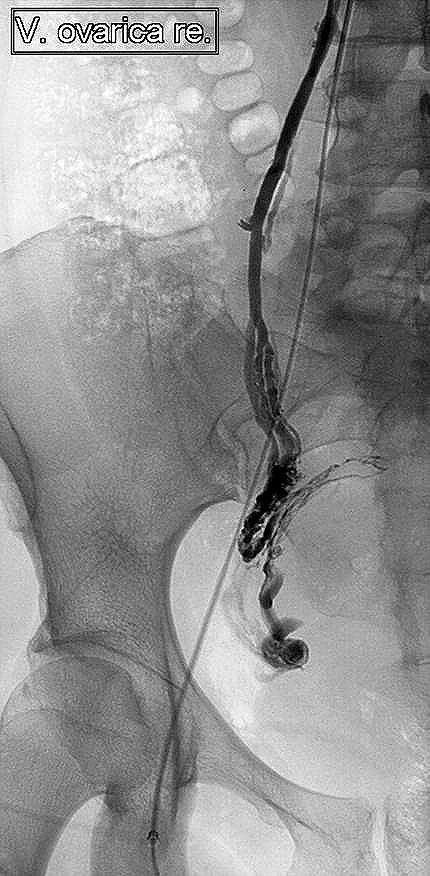
Abbildung 1: Selektive Stufenkatheterunterschung: Kathetergestützte Kontrastmitteldarstellung des venösen Abstromgebietes des rechten Ovars vor der Entnahme einer selektiven Serumprobe zur Hormonwertbestimmung.
Abbildung 2
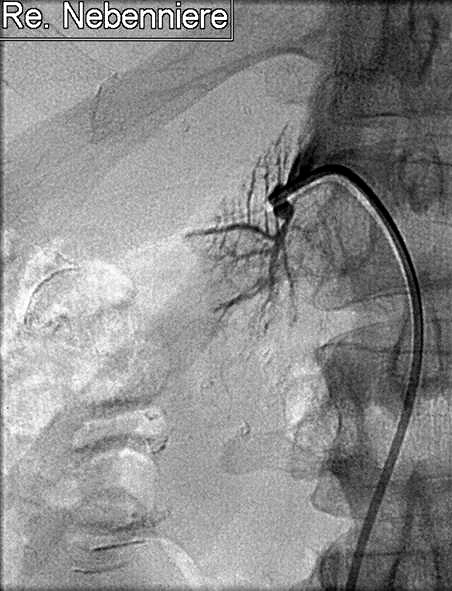
Abbildung 2: Selektive Stufenkatheterunterschung: Kathetergestützte Kontrastmitteldarstellung des venösen Abstromgebietes der rechten Nebenierenrinde vor der Entnahme einer selektiven Serumprobe zur Hormonwertbestimmung.
Quelle: Radiologische Klinik Universitätsklinik Bonn
Therapie
Grundlage der Behandlung ist die Reduktion der Androgenproduktion im Ovar und in der Nebennierenrinde sowie die Blockade der Androgenwirkung am Erfolgsorgan.
Durch orale Kontrazeptiva mit antiandrogen wirksamen Gestagenen (Cyproteronazetat, Chlormadinonazetat, Dienogest, Drospirenon) wird sowohl die ovarielle Androgenproduktion supprimiert, als auch der periphere Androgenrezeptor blockiert. Außerdem wird durch die estrogenbedingte SHBG Synteseinduktion die Konzentration frei verfügbaren Testosterons gesenkt.
Durch 5-alpha Reduktaseinhibitoren (z. B. Finasterid, Spironolacton, Progesteron), die topisch oder systemisch angewendet werden, wird die Konversion von Testosteron zu dem wesentlich stärker androgen wirksamen Dihydrotetosteron (DHT) unterbunden.
Durch eine Glukokortikoidgabe (Prednisolon, Dexamethason) wird die ACTH-Freisetzung und daher auch die adrenale Androgenproduktion supprimiert.
Eine lokale Behandlung durch Epilation (Laser, Creme etc.) ist nur sinnvoll, wenn zuvor eine Korrektur der Androgenproduktion erzielt wurde.
Bei Kinderwunsch und Hyperandrogenämie mit ovarieller Funktionsstörung ist eine ovarielle Stimulationstherapie mit Clomifenzitrat oder follikelstimulierendem Hormon (FSH) indiziert. Zunehmend wird vor allem bei gleichzeitig bestehender Insulinresistenz eine Behandlung mit Metformin durchgeführt.
Vor Beginn einer medikamentösen Therapie ist bei sehr hohen Androgenwerten der Ausschluss einer tumorbedingten Endokrinopathie obligat. Ein androgenproduzierender Tumor im Ovar oder in der NNR muss in aller Regel operativ entfernt werden.
Literatur
Ferriman DG, Journal of Clinical Endocrinology and Metabolism 1961; 21 (11): 1440 – 1447
Kraw M, Endocrinology Rounds 2006, 6 (2)
Labrie F, The Journal of Steroid Biochemistry and Molecular Biology 2006; 99 (4-5): 182 – 188
Rosenfield RL, New England Journal of Medicine 2005; 353: 2578 – 2588
Rotterdam ESHRE/ASRM-Sponsored PCOS Consensus Workshop Fertility Sterility 2004; 81:19

