Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik "Patientin mit akutem Beinschmerz" - akute periphere arterielle Verschlusskrankheit
wissenschaftlich begutachtet durch Professor Dr. Malte Ludwig, Chefarzt der Abteilung Angiologie und Phlebologie am Krankenhaus Tutzing.
von Dr. Dirk K. C. Sieber
Inhalt
Endoluminäre mechanische Thrombembolektomie
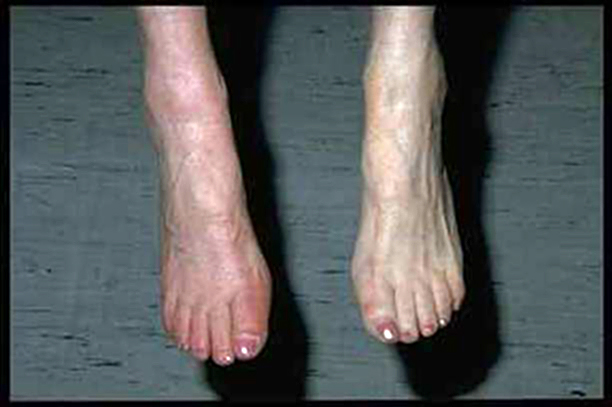
Abbildung 1:.Linker Unterschenkel gegenüber rechts kühl und blass.
Quelle: Prof. Ludwig
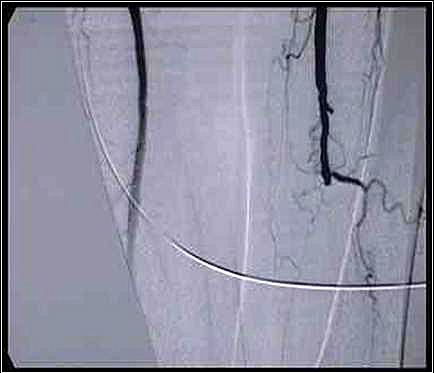
Abbildung 2:Ausschnitt der Arteriographie der Patientin aus der Knie- und der proximalen Unterschenkelregion. Plötzlicher, kuppelartiger Abbruch der Kontrastmittelsäule in Höhe der A. poplitea links.
Quelle: Prof. Ludwig
Definition
Die akute arterielle Verschlusskrankheit (pAVK) entwickelt sich plötzlich oder subakut und ist bedingt durch einen embolischen oder thrombotischen Verschluss eines arteriellen Gefäßes. Es entsteht eine Minderperfusion der betroffenen Extremität, die im Falle ungenügend präformierter Kollateralen organ- beziehungsweise lebensbedrohliche Auswirkungen haben kann.
Epidemiologie
Die akute pAVK hat eine Inzidenz von etwa 7 bis 14/100.000 Einwohner im Jahr. Ihr Anteil unter allen Gefäßerkrankungen, die im Krankenhaus behandelt werden, beträgt 10-16% (Statistisches Bundesamt 1998). Die akute periphere arterielle Verschlusskrankheit ist trotz mit einer sehr hohen Morbidität und Mortalität verbunden. So beträgt in den ersten 30 Tagen nach Beginn einer akuten Beinischämie das Amputationsrisiko zwischen 10% und 30%, die Sterblichkeit 15-30%.
Ätiologie
Akute Arterienverschlüsse werden überwiegend durch Embolien (70-80%), weniger häufig durch akute lokale Thrombosen (20-30%) verursacht (H.H. Eckstein 1998). In 10% bis 15% der Fälle ist eine Differenzierung der Verschlussursache anhand der Anamnese und der klinischen Untersuchung allein nicht möglich.
Arterielle Embolien haben meist kardiale Ursachen (80-90%). Über 70% der kardialen Embolien entwickeln sich auf dem Boden einer absoluten Arrhythmie bei Vorhofflimmern, seltenere Ursachen sind Herzklappenvitien, Herzwandaneurysma, Endokarditis, Tumoren des linken Herzens, Vorhofmyxom, prothetischer Herzklappenersatz, dilatative Kardiomyopathie oder paradoxe arterielle Embolien über ein offenes Foramen ovale.
Nichtkardiale Emboliequellenführen nur in etwa 10-20% der Fälle der akuten pAVK zu peripheren Embolien. Hierzu zählen Aneurysmen der aortoiliacalen und der femoro-poplitealen Region, Cholesterinembolien, arteriosklerotische Plaques, Kompressions-syndrome, Katheterembolien oder iatrogene Gefäßschäden. Auch Tumoren (Bronchial-CA, Lungenmetastasen und Angiosarkome) sowie Fremdkörper können Ursache nichtkardialer Emboliequellen sein.
Weitere Ursachen akuter Arterienthrombosen können Dissektionen, Traumata, Vaskulitiden, postoperative Gefäßschäden, paraneoplastische Syndrome und Medikamente sein. Die zystische Adventitiadegeneration, die Phlegmasia coerulea dolens oder eine Hyperkoagulopathie sind seltene Genesen akuter arterieller Thrombosen. Herzinsuffizienz und Hypovolämie praedisponieren zur Ausbildung arterieller Thrombosen.
Lokalisation
Die akute arterielle Verschlusserkrankung befällt die unteren Extremitäten wesentlich häufiger als die oberen. Die akute Extremitätenischämie betrifft in 85% der Fälle eine – wesentlich seltener zwei Gliedmaßen (H. Alfke et al. 2003). Prädilektionsstellen akuter thrombotischer Arterienverschlüsse sind vorgeschädigte Gefäße infolge einer obliterierenden, dilatierenden Arteriopathie oder Gefäßnähte. Die häufigste Lokalisation akuter arterieller Verschlüsse ist die A. femoralis mit gleichzeitiger Okklusion von 2 oder 3 Unterschenkelarterien gefolgt von Verschlüssen der A. iliaca und A. poplitea.
Diagnose
Eine schnelle Diagnose durch exakte Anamneseerhebung, klinische Untersuchung sowie zügige bildgebende Diagnostik gefolgt von einer sofortigen Wiederherstellung der gestörten arteriellen Zirkulation bei akuter pAVK ist für den Patienten von entscheidender prognostischer Bedeutung. Daher gilt der Patient mit akuter Extremitätenischämie als Notfall- und Hochrisikopatient. Das Ausmaß der Organschädigung ist abhängig von der Ischämietoleranz der jeweiligen Gewebe und beträgt für Haut, Muskulatur und Nervengewebe 12, 6 bis 8 beziehungsweise. 2 bis 4 Stunden.
Anamnese und körperliche Untersuchung
Fragen nach dem Zeitpunkt des Beginns des Extremitätenschmerzes und vorbestehende Erkrankungen geben Aufschluss über das Alter und die Ursache des Arterienverschlusses. Für eine Embolie spricht ein schlagartiges Auftreten der Symptome ohne anamnestisch zuvor bekannte Claudicatioschmerzen. Patienten mit akuter pAVK embolischer Genese geben anamnestisch Herzrhythmusstörungen, Herzklappenfehler, eine koronare Herzerkrankung oder ein Aortenaneurysma an. Dagegen machen vorbestehende Claudicatioschmerzen und das Vorliegen von Arteriosklerose-Risikofaktoren eine thrombotische Genese des Verschlussereignisses wahrscheinlich. Eine akute pAVK kann sich auch als paraneoplastisches Syndrom bei Tumorpatienten entwickeln.
Die gründliche körperliche Untersuchung mit der seitenvergleichenden Pulspalpation, Prüfung der Gliedmaßentemperatur und Inspektion der Hautfarbe geben klinischen Aufschluss über die Lokalisation des akuten Arterienverschlusses. Bedingt durch die gestörte arterielle Zirkulation ist die vom akuten Arterienverschluss betroffene Extremität blass. Zusätzlich sollte der Füllungszustand der Hautvenen beachtet werden. Bei einer kritischen Extremitätenischämie ist der Perfusionsdruck beziehungsweise die „vis a tergo“ im peripher arteriellen Stromgebiet unzureichend, sodass der intravasale Druck niedriger als der Gewebedruck ist und die kleinen Gewebearterien kollabieren. Damit ist der venöse Rückstrom - erkennbar an der fehlenden Hautvenenfüllung – gestört.
Die Herzauskultation kann Aufschluss über ein Herzvitium als kardiale Ursache der akuten pAVK geben.
Bei einer länger oder lang andauernden vollständigen akuten Ischämie kommt es zu einem Verlust von Sensibilität und Motorik oder zur Ausbildung einer Nekrose. Von der Nekrosebildung sind die Gewebeabschnitte, die weit distal des Arterienverschlusses gelegen sind - insbesondere die Akren - betroffen.Symptome
Das Ausmaß der Symptomatik des akuten Arterienverschlusses ist abhängig von seiner Art, Lokalisation und eventueller Kollateralisation.
Bei embolischem Arterienverschluss fehlen meist Kompensationsmechanismen über ein vorbestehendes Kollateralsystem, sodass hier die typischen klinischen Symptome nach Pratt bis hin zur kritischen Extremitätenischämie auftreten. Bei einem akuten thrombotischen Verschluss auf dem Boden einer vorbestehenden peripheren arteriellen Verschlusskrankheit entwickeln sich die Symptome aufgrund bereits ausgebildeter Kollateralgefäße meist langsamer und weniger schwerwiegend. Die typischen klinischen Symptome der akuten pAVK wurden 1954 erstmals von PRATT (G. H. Pratt 1954) zusammengefasst und aufgelistet (6 P´s nach Pratt):
| pain | (Schmerz) |
| pulselessnes | (Pulsverlust) |
| pallor | (Blässe) |
| paresthesia | (Gefühlsstörung) |
| paralysis | (Bewegungsunfähigkeit) |
| prostration | (Schock) |
Die geschilderten Symptome nach PRATT entsprechen dem kompletten Ischämiesyndrom. Diese können jedoch aufgrund einer noch vorhandenen Minimalperfusion unterschiedlich ausgeprägt sein und nicht alle gleichzeitig vorliegen. In diesem Falle spricht man vom inkompletten Ischämiesyndrom. Das inkomplette Ischämiesyndrom findet sich häufig bei akuter pAVK thrombotischer Genese (zum Beispiel aszendierende arterielle Thrombose bei vorbestehender Stenose) und bei Kollateralenbildung. Blässe und Pulsverlust distal des arteriellen Verschlusses sind Erstsymptome des akuten Arterienverschlusses. Die Abkühlung der betroffenen Extremität stellt sich oft erst mit Zeitverzögerung ein. Die Blauverfärbung der ischämischen Extremität weist auf einen Blutstromstillstand im Kapillarstrombett mit Ausschöpfungszyanose hin und kennzeichnet die schwere Extremitätenischämie. Sind zusätzlich Sensibilität und Motorik gestört, so liegt eine komplette Ischämie mit unmittelbar drohendem Extremitätenverlust vor. Bei Aorten- oder Beckenarterienverschlüssen ist die Ausbildung einer Schocksymptomatik möglich.
Ein sogenanntes Torniquet-Syndrom (Myoglobinämie beziehungsweise Myoglobinurie, Azidose mit Hyperkaliämie, Volumenverlust sowie akutes Nierenversagen bei Crushniere) kann entstehen, wenn die Ischämie länger als 6 Stunden besteht.
Unter Berücksichtigung klinischer und dopplersonographischer Kriterien definierten Rutherford und Mitarbeiter eine diagnostisch und therapeutisch wegweisende Stadieneinteilung der akuten pAVK (Tabelle 1).
Tabelle 1: Klinische Stadieneinteilung der akuten pAVK nach Rutherford et al. (R.B. Rutherford et al. 1997)
Stadien-Einteilung | Erklärung/Prognose | Befund |
| Doppler-Signal | ||
|---|---|---|---|---|---|---|
Gefühlsstörungen | Bewegungsstörungen | arteriell | venös | |||
I funktionsfähige | nicht sofort gefährdet | Keine | Keine | hörbar | hörbar | |
II gefährdete |
|
|
|
|
| |
a | marginal | Extremitätenerhalt bei zeitgerechter Wiederherstellung der arteriellen Perfusion | minimal (Zehen) oder keine | Keine | nicht hörbar | hörbar |
b | unmittelbar | Extremitätenerhalt bei sofortiger Wiederherstellung der arteriellen Perfusion | zehenüberschreitendmit Ruheschmerzen | leicht bis mäßig | nicht hörbar | hörbar |
III irreversibel | Nekrose oder irreversible | ausgedehnter Sensibilitätsverlust | Lähmung (Rigor) | nicht hörbar | nicht hörbar | |
In der vorliegenden Kasuistik handelt es sich also um ein Stadium 2b nach Rutherford.
Apparative Diagnostik
Da die Prognose der akuten pAVK von einem möglichst kurzen Zeitfenster zwischen Symptombeginn und Einsetzen der Therapiemaßnahmen abhängig ist, sollten nur ausgewählte, aussagekräftige und zeitsparende Untersuchungsmethoden in der apparativen Diagnostik zur Anwendung kommen.
Voraussetzung für das optimale Management der akuten Extremitätenischämie ist daher das Erkennen der Notfallsituation durch den erstbehandelnden Arzt und die sofortige Einweisung in eine Klinik, die über geeignete diagnostische und therapeutische Verfahren verfügt. So bietet zum Beispiel ein interdisziplinäres vaskuläres klinisches Kompetenzzentrum, das über eine Angiologie, Radiologie und Gefäßchirurgie verfügt, die hierfür notwendige Strukturqualität.
Ziele des Einsatzes apparativer diagnostischer Maßnahmen bei der akuten pAVK sind die Klärung des Ausmaßes und der exakten Lokalisation des akuten Arterienverschlusses sowie seiner Ursache.
Verschlusslokalisation
Nicht-invasive apparative Verfahren mit wenig Zeitaufwand sind
- die Oszillographie,
- die Dopplerdruckmessung,
- die cw-Dopplersonographie und
- die farbkodierte Duplexsonographie.
Anhand der Analyse der arteriellen Oszillogramme gelingt der Nachweis der Lokalisation des Verschlusses. Distal des Arterienverschlusses sind abgeschwächte, verbreiterte oder fehlende Oszillationen zu erkennen.
Der Einsatz der Dopplermethoden ist neben der Verschlusslokalisation auch zur Stadiendefinition nach Rutherford notwendig (siehe Tabelle 1). Kriterien sind hier die hörbaren oder nicht hörbaren Signale über dem arteriellen Verschluss beziehungsweise über den Venen.
Die Bestimmung des Knöchel-Arm-Index’ (ABI) mit Hilfe der Dopplerdruckmethode gibt Aufschluss über das Ausmaß der Kompensation des akuten peripher-arteriellen Verschlussereignisses. Normal ist ein ABI von > 0,97. Schlecht kollateralisierte Arterienverschlüsse sind charakterisiert durch einen ABI von < 0,6. Knöchelarteriendrücke der A. tibialis posterior und anterior von < 50mmHg weisen auf eine kritische Extremitätenischämie hin. Mit Unterschreiten dieses kritischen Perfusionsdruckes ist im betroffenen Gewebe der Gewebedruck höher als der Gefäßinnendruck, sodass der arterielle Bluttransport über die Kapillaren in die Venenstrombahn nicht mehr gewährleistet ist.
Distal eines akuten Arterienverschlusses lässt sich entweder kein Dopplersignal oder ein monophasisches Signal mit verbreiterter Kurve und erhöhtem enddiastolischen Blutfluss ableiten.
Farbduplexsonographisch ist distal des akuten Arterienverschlusses entweder kein oder nur ein schwaches monophasisches arterielles Strömungssignal ableitbar. Das Lumen im Bereich des Verschlusses kann von variabler Echogenität sein. Hier ist bedingt durch die komplette Gefäßokklusion kein Dopplersignal mehr ableitbar. Gemessen an der DSA hat die periphere Farbduplexsonographie hinsichtlich der Diagnose von Arterienverschlüssen eine hohe diagnostische Treffsicherheit mit einem positiven beziehungsweise negativen Vorhersagewert von 91% beziehungsweise 100% bei einer Sensitivität und Spezifität von 92% und 99% (M. Ludwig 1998).
Im Vergleich zur Angiographie lassen sich in der Farbduplex-Sonographie komplett oder inkomplett thrombosierte Arterienaneurysmen als mögliche Verschlussursache darstellen.
Bis heute ist die klassische intraarterielle digitale Subtraktionsangiographie (DSA) der „Goldstandard“ der bildgebenden Diagnostik der akuten arteriellen Verschlusskrankheit und der akuten Ischämie. Mit ihr gelingt meist die Differenzierung zwischen arterieller Embolie und arterieller Thrombose. Der Nachteil der DSA ist neben der Strahlenexposition die potentielle Gefahr der fortschreitenden Niereninsuffizienz durch die Kontrastmittelbelastung bei Patienten mit Nierenvorschädigung. In diesem Zusammenhang ist eine aktuelle Veröffentlichung der amerikanischen Arzneimittelzulassungsbehörde FDA erwähnenswert, nach der auch im Zusammenhang mit der Magnetresonanzangiographie (MRA) zu erhöhter Vorsicht wegen möglicher Nebenwirkungen (zum Beispiel Gewebe- und Organfibrose) bei Anwendung eines bestimmten gadolinium-basierten Kontrastmittels bei Patienten ab Stadium II einer Niereninsuffizienz geraten wird (FDA Alert 2006).
Der akute Arterienverschluss ist angiographisch durch ein plötzliches Abbrechen der Kontrastmittelsäule charakterisiert. Bei der arteriellen Embolie zeigt sich darüber hinaus ein sogenanntes „Kuppelphänomen“, worunter eine nach oben konvex gestaltete abgerundete Kontrastmittelaussparung im Bereich des proximalen Embolusanteils verstanden wird. Darüber hinaus fehlen bei der Embolie meist ausgebildete Kollateralgefäße. Beim akuten thrombotischen Arterienverschluss zeigen sich häufig vorbestehend ausgebildete Umgehungsgefäße.
Die Vorteile einer DSA kann man wie folgt zusammenfassen (Alfke et al. 2003):
- Hohe diagnostische diagnostische Spezifität, die in Abhängigkeit von der Etage der unteren Extremität zwischen 93% (distal) und 98% (proximal) liegt.
- Gewinnung einer Übersicht anhand der Darstellung des gesamten arteriellen Gefäßsystems von Höhe der Nierenarterien bis zu den Fußarterien in hoher Auflösung.
- Möglichkeit der sofortigen interventionellen endovaskulären Behandlung.
Konkurrenzfähig zur DSA ist die kontrastmittelgestützte 3D-MRA (3D-CE-MRA) bei der chronischen kritischen Ischämie (chronic critical limb ischemia, CLI), nicht jedoch bei der akuten Ischämie. Dies liegt aber nicht an der geringeren Aussagekraft, sondern mehr im Patientenmanagement begründet, da die DSA unmittelbar zum therapeutischen Eingriff erweitert werden kann. Der primäre Einsatz der kontrastmittelgestützten MRA kann mit einem modernen 1,5 Tesla-Gerät ansonsten in jedem Stadium der pAVK erfolgen und hat die diagnostische DSA auch in der täglichen Praxis schon weitgehend ersetzt (NM Khilnani et al. 2002). Ein zweites Konzept besteht in manchen Kliniken in der Kombination aus Farb-Duplexuntersuchung und anschließender DSA in Interventionsbereitschaft. Hierbei wird allerdings auf die Darstellung der (infrarenalen) Aorta und der Beckenstrombahn verzichtet (zum Beispiel akuter Verschluss der A. poplitea oder der distalen A. femoralis superficialis). Voraussetzung für diese Strategie ist ein verlässlicher Duplexbefund. Der zusätzliche Einsatz der MD-CTA bietet sich vor allem dann an, wenn zum Beispiel eine Emboliequelle (Aneurysma) im Verlauf der gesamten Aorta und der Beckenstrombahn ausgeschlossen werden soll. Ein Nachteil der MD-CTA besteht in der Jodexposition, der potentiellen kontrastmittelinduzierten Niereninsuffizienz und der im Vergleich zur MRA deutlich höheren Volumenbelastung.
Verschlussursache
Zur Klärung der Verschlussursache, die auch in der vorliegenden Kasuistik während des stationären Aufenthaltes der Patientin notwendig ist, stehen verschiedene diagnostische Methoden zur Verfügung, zum Beispiel
- Labordiagnostik,
- EKG,
- Langzeit-EKG,
- Thorax Röntgen und
- die verschiedenen Arten der Echokardiographie.
Der laborchemische Nachweis eines erhöhten Serumlaktat- und -kaliumwertes, einer Myoglobinaemie, Myoglobinurie gibt Aufschluss auf eine längere Ischämiedauer. Laborchemisch sollte das atherogene Risikoprofil mit Bestimmung der Fettwerte und des Blutzuckers ermittelt werden. Gerinnungsanalysen zum Nachweis einer Hyperkoagulopathie beziehnungsweise Thrombophilie können Gerinnungsstörungen als Grunderkrankung, zum Beispiel APC-Resistenz, Antiphospholipidsyndrom oder Protein C- und S-Mangel, differenzieren.
Das laborchemische Notfallprogramm bei akuter pAVK sollte folgende Parameter erfassen:
- Hb,
- Hk,
- Thrombozytenzahl,
- Leukozyten,
- Kreatinin,
- Kreatinphosphokinase,
- Kalium,
- Laktat,
- PTT,
- Quick,
- Blutgase,
- pH-Wert und
- Blutgruppe.
Im EKG nachweisbare Herzrhythmusstörungen oder Herzinfarktzeichen weisen auf eine kardiale Genese der akuten pAVK hin. Bei persistierenden ST-Strecken-Hebungen nach Myokardinfarkt besteht der Verdacht auf ein Herzwandaneurysma als kardiale Emboliequelle. Intermittierende Herzrhythmusstörungen werden durch ein Langzeit-EKG erfasst.
Bei der Röntgen-Thoraxuntersuchung können Vergrößerungen der Herz- oder Aortenkontur ein Herzwandaneurysma beziehungsweise ein Aortenaneurysma anzeigen. Darstellbarer Klappenkalk lässt eine kardiale Mikroembolie als Genese vermuten.
Klappenvegetationen oder ein Aneurysma können Ursachen für eine kardiale Embolie sein. Ausgeschlossen können diese mittels transösophagealer Echokardiographie, die mit einer deutlich höheren Sensitivität und Spezifität (97-100% und 65-100%) gegenüber der transthorakalen Echokardiographie (59-85% und 63-96%) einhergeht (D. Beuckelmann et al. 1994). Zur Darstellung intrakardialer Thromben als Emboliequelle hat sich die kombinierte Anwendung von transthorakaler und transösophagealer Echokardiographie bewährt, da hinsichtlich der Erkennung linksventrikulärer Thromben die transthorakale der transösophagealen Echokardiographie überlegen ist.
Farbduplexsonographisch können Hinweise auf eine bereits bestehende Kollateralisierung, für vorliegende Aneurysmen ohne oder mit Thrombosierung, Gefäßwandschäden mit Plaque- beziehungsweise Stenosebildung oder Dissektionen erkannt werden.
Mit der Angiographie kann die Differenzierung zwischen arterieller Thrombose (Nachweis einer bereits bestehenden Kollateralbildung) oder Embolie („Kuppelphänomen“, wenig Kollateralen) erfolgen. Mittels CT oder MRA können thrombosierte Aneurysmen dargestellt werden.
Differentialdiagnose
Extremitätenschmerzen können vaskuläre und extravaskuläre Ursachen haben.
| Tabelle 2: Differentialdiagnose von Extremitätenschmerzen | |
|---|---|
Vaskuläre Ursache | Extravaskuläre Ursache |
Venenthrombose | Spinalkanalstenose |
Therapie
Unter Berücksichtigung allgemeiner Sofortmaßnahmen sollten in interdisziplinärer Zusammenarbeit zwischen Angiologen, Radiologen und Gefäßchirurgen rasch und zeitnah spezielle Therapiestrategien abgestimmt und eingeleitet werden. Dabei sind die speziellen therapeutischen Maßnahmen abhängig von der Genese des akuten Arterienverschlusses und dem Vorliegen einer kompletten oder inkompletten Ischämie (Stadieneinteilung nach Rutherford).
Bei noch erhaltener Sensomotorik im Stadium I der akuten pAVK nach Rutherford können in Ausnahmefällen nach Einleitung therapeutischer Allgemeinmaßnahmen und der Antikoagulation die speziellen lumeneröffnenden Maßnahmen am Folgetag des Akutereignisses stattfinden.
In den Stadien II und III nach Rutherford müssen alle diagnostischen und therapeutischen Maßnahmen notfallmäßig ohne Zeitverzögerung erfolgen.
Aktuell steht ein breites Angebot an innovativen revaskularisierenden Behandlungsmöglichkeiten zur Verfügung, dessen Auswahl sich am Befund des Patienten und an den strukturellen, personellen und apparativen Gegebenheiten der behandelnden Einrichtung orientiert.
Sofortmaßnahmen
Die betroffene Extremität sollte tief gelagert und gepolstert werden. Insbesondere die akralen Bereiche bedürfen eines weiteren Schutzverbandes. Kälte- beziehungsweise Wärmeapplikationen sind kontraindiziert.
Zur Verhinderung der weiteren Embolie- beziehungsweise Thrombenbildung ist die sofortige intravenöse Antikoagulation mit 5000 bis 10.000 IE unfraktioniertem Heparin einzuleiten. In der vorliegenden Kasusitik wurde der Patientin 8000 I.E. Heparin i.v. verabreicht.
Gegebenenfalls ist eine adäquate Schmerzlinderung notwendig, wobei i.m.-Injektionen vermieden werden sollten, um eine eventuelle Lysetherapie (Blutungsrisiko) nicht zu gefährden.
Chirurgische Therapie
Zu den operativen Maßnahmen der akuten arteriellen Verschlusskrankheit zählen die Embolektomie, Thrombektomie, Thrombendarteriektomie und Bypass-Anlagen. Grundsätzlich ist eine notfallmäßige chirurgische Therapie indiziert, wenn ein komplettes Ischämiesyndrom mit akuten Verschlüssen großer Extremitätenarterien proximal der Leiste oder Ellenbeuge vorliegt (G. Halter et al. 2003). Der klassische operative Eingriff ist die Thrombembolektomie nach Fogarty. Arterienverschlüsse distal des Leistenbandes eignen sich für ein kombiniertes Vorgehen mittels Katheterverfahren und lokaler Lyse (AT Hirsch et al. 2006).
Bei akuter pAVK mit inkompletten Ischämiesyndrom, speziell beiakuter embolischer Genese, kommen eher kombinierte Behandlungsmethoden (Fibrinolyse, kathetergestützten Verfahren) in Betracht. Bei Bedarf muss zur Rezidivvermeidung die dem akuten Verschluss zu Grunde liegende Stenose mit einem offen chirurgischen Vorgehen beseitigt werden (AT Hirsch et al. 2006).
Thrombolysetherapie
Zur Lysebehandlung akuter Arterienverschlüsse ist der lokale intraarterielle Einsatz von Urokinase und Plasminogen-Aktivator (rtPA) üblich.
Zur lokalen Infusionsthrombolyse wird über den vor den Thrombus platzierten intraarteriellen Katheter lokal langsam kontinuierlich bis zu einer entsprechenden Maximaldosis das Fibrinolytikum infundiert. Nach 6 bis 24 Stunden erfolgt die angiographische Kontrolle und eventuelle Dosisreduktion.
Zur Infiltrationsfibrinolyse wird das Fibrinolytikum durch Vorschieben des endoffenen Katheters direkt in den Thrombus appliziert. Nach Passage des Thrombus eignen sich endständig verschlossene Kathetersysteme mit seitlichen Öffnungen (Multiside-slit-Katheter) zur Benetzung des gesamten Thrombus mit dem Fibrinolytikum. Bei der Infiltrationsthrombolyse arterieller Verschlüsse kommen niedrigere Fibrinolytikadosierungen zur Anwendung als bei der lokalen Infusionsthrombolyse.
Neben der kontinuierlichen Applikation des Thrombolytikums können auch mittels automatisierter Pulsed-Spray-Infusionspumpen gepulste Druckspitzen während der Infiltrationsthrombolyse angewendet werden. Diese „Pulsed-Spray-Thrombolyse“-Technik bewirkt neben der Lyse die zusätzliche mechanische Zerstörung des Thrombus. Im Vergleich zur einfachen Infiltrationsthrombolyse und der Infusionsthrombolyse sind mit diesem Verfahren wesentlich kürzere Zeiten zur Thrombusauflösung bei niedrigeren Majorkomplikationsraten (4% vs. 15-20%) erzielbar (JJ. Bookstein et al. 1989).
Die Ergebnisse interventioneller Katheter- und Lysestudien bei akuter pAVK sind uneinheitlich, da in die einzelnen Untersuchungen sowohl akute als auch subakute und chronische peripher arterielle Erkrankungstadien eingeschlossen wurden. In den ACC/AHA Guidelines for the Management of Patients With Peripheral Arterial Disease 2006 (AT Hirsch et al. 2006) wird aber die intraarterielle lokale Fibrinolysetherapie mittels Katheter bei Patienten mit hoher Co-Morbidität als risikoarme Alternative zur Operation empfohlen.
Endoluminäre mechanische Thrombembolektomie
Die endoluminäre Therapie der akuten Extremitätenischämie umfasst mehrere Techniken, die alleine oder in Kombination mit einer lokalen fibrinolytischen Therapie angewendet werden können. Dabei wird initial das okklusive thromboembolische Material zerkleinert und entfernt. Anerkannte effiziente Verfahren der mechanischen Thrombektomie sind die
- perkutane Aspirationsthromboembolektomie,
- mechanische Fragmentations-Kathetersysteme,
- hydro-dynamische Kathetersysteme.
Ungeeignet für kathetergestützte mechanische Thrombembolektomieverfahren sind akute Verschlüsse der Beckenarterien und die Bifurkation der A. femoralis. Sie sollten eher chirurgisch angegangen werden. Dagegen sind infrainguinale Arterienverschlüsse mit akutem Ischämiesyndrom sowie angiographisch schlechtem peripheren Ausstrom („run off“) eine Indikation zu endovaskulären Thrombektomieverfahren.
Antikoagulation
Während und im Anschluss an die interventionelle Behandlung sollte intraarteriell Heparin in einer Dosierung von 800 bis 1000 IE / h verabreicht werden, um eine frühe Rethrombose zu vermeiden. Ist eine Emboliequelle eines akuten Arterienverschlusses bekannt oder nicht ausschließbaroder behebbar, so ist eine längerfristige beziehungsweise lebenslange orale Antikoagulation mit Vitamin-K-Antagonisten indiziert. Darüber hinaus wird die orale Antikoagulation auch nach Anlage eines kniegelenksüberschreitenden Bypasses empfohlen.
Thrombozytenaggregationshemmer
Die andauernde Gabe von Thrombozytenaggregationshemmern ist indiziert:
- nach Thrombektomie
- nach Thrombendarteriektomie
- nach supragenualen Bypass-Operationen
- bei generalisierter Arteriosklerose
Literatur
- Alfke H, Geks J, Wagner HJ. Radiologische Diagnostik und Therapie bei akuter Extremitätenischämie. Chirurg 2003; 74:1110-1117.
- Beuckelmann DJ, Erdmann E. Bildgebende Verfahren zur Diagnostik der Aortendissektion. Internist 1994; 35: 999-1005.
- Bookstein JJ, Fellmeth B, Roberts A et al. Pulsed-spray pharmacomechanical thrombolysis: preliminary clinical results. Am J Roentgenol 1989; 152: 1097-1100.
- Dormandy JA, Rutherford RB. Management of peripheral arterial disease (PAD). TASC Working Group. Trans Atlantic Inter-Society Concensus (TASC). J Vasc Surg 2000; 31: S1-S296.
- Eckstein HH. Akute Extremitätenischämie. Chirurg 1998; 69:38-47.
- FDA Alert. Drug Information J-888-INFO-FDA. FDA Alert 12/2006.
- Halter G, Orend KH, Sunder-Plassmann L. Die akute Extremitätenischämie. Chirurg 2003; 74:1118-1127.
- Hirsch AT, Haskal ZJ, Hertzer NR. ACC/AHA guidelines for the management of patients with peripheral arterial disease. 2006.
- Khilnani NM, Winchester PA, Prince MR et al. Peripheral vascular disease: combined 3D bolus chase and dynamic 2D MR angiography compared with x-ray angiography for treatment planning. Radiology 2002; 224(1): 63-74.
- Statistisches Bundesamt: Todesursachenstatistik von Deutschland 1998. Statistisches Bundesamt Wiesbaden.

