Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik "Patientin mit Husten, Dyspnoe und oberer Einflussstauung"
wissenschaftlich begleitet von Peter Brossart, Ärztlicher Direktor der Medizinischen Klinik III der Universitätsklinik Bonn und Facharzt für Hämatologie und Onkologie und Malte Ludwig, Chefarzt der Abteilung Angiologie und Phlebologie am Krankenhaus Tutzing.
von Dr. Ricarda Clarenbach
Inhalt
Abbildung 1
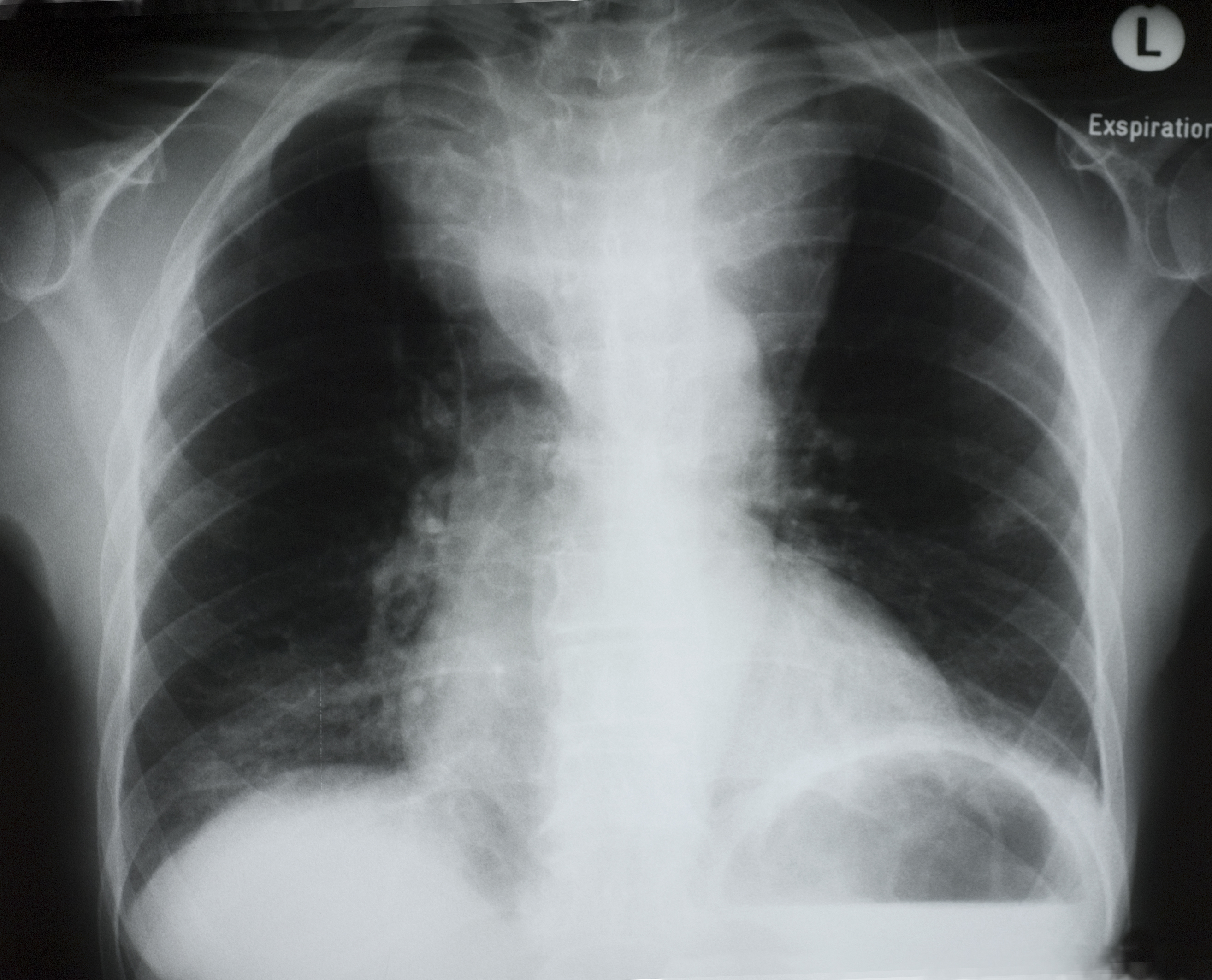
Abbildung 1:Röntgen-Thorax der Patientin .
Quelle: Clarenbach
Abbildung 2
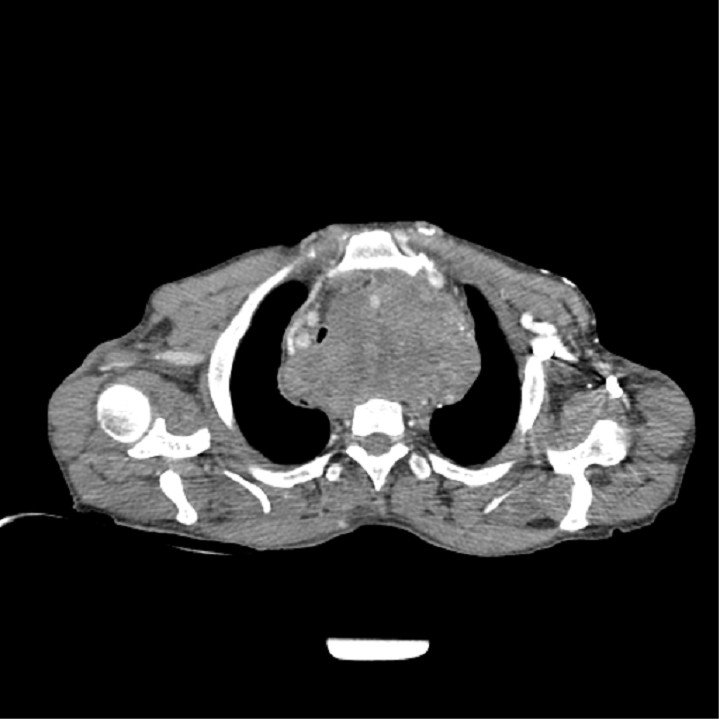
Abbildung 2: CT-Thorax-Bild der Patientin.
Quelle: Schmiedel
Klinische Manifestationen
Der Symptomkomplex Dyspnoe, Husten, inspiratorischer Stridor, Schwellung der Hals- und Gesichtsweichteile, insbesondere periorbital, ggf. auch der Arme, sowie Dysphagie und Kollateralkreisläufe an der ventralen Brustwand ist typisch für das Vorliegen eines Vena cava superior Syndroms (VCSS), dem eine Obstruktion der Vena cava superior zugrunde liegt. Der Grad der Abflußbehinderung und die Dynamik des zugrunde liegenden Prozesses bestimmen das Ausmaß der Beschwerden. Weitere, seltener auftretende Symptome sind Zyanose, Gesichtsplethora, Bewußtseinstrübungen oder Kopfschmerzen infolge eines cerebralen Ödems, sowie schweren Fällen ein Exophthalmus oder ein Glottis- oder Larynxödem. Insbesondere die begleitende Kompression der Trachea kann eine sofortige Intervention erfordern. Beim Vorbeugen oder Hinlegen verschlimmern sich oft die Beschwerden. Bei einem Drittel der Patienten entwickeln sich die Symptome über eine Periode von 2 Wochen, bei den restlichen über einen längeren Zeitraum (1).
Pathophysiologie
Ursächlich sind entweder eine Kompression der Vene von außen, eine Invasion durch pathologische Prozesse der die Vena cava umgebenden Strukturen oder eine Thrombose der Vena cava superior mit einem konsekutiven Anstieg des cervikalen venösen Druckes von 2-8 auf 20-40 mmHg (2). Bei den sich ausbildenden möglichen Kollateralkreisläufen ist der über die Vena azygos der bedeutendste. So konnte im Tierexperiment beobachtet werden, daß die Obstruktion der VCS unterhalb des Niveaus der Vena azygos nicht toleriert wird (3). Andere Umgehungskreisläufe betreffen die V. mammaria interna, die Venen der lateralen Thoraxwand, paraspinal und des Ösophagus.
Generelle Maßnahmen: An den betroffenen gestauten Venen sollten wegen der verzögerten Absorption keine Infusionen angeschlossen oder intramuskulären Injektionen vorgenommen werden.
Äthiologie
Dem VCSS liegen maligne Tumoren, Infektionen, Fibrosen des Mediastinums und Thrombosen der Vena cava superior (VCS), insbesondere bei liegenden Langzeit-Verweilkathetern in der VCS, zugrunde. Vor 50 Jahren zählten infektiöse Ursachen wie das syphillitische Aortenaneurysma und die Tuberkulose zu den häufigsten Gründen. In unserer Zeit sind in 60-85% der Fälle maligne Tumore für das VCSS verantwortlich (4). Bronchialkarzinome und Lymhpome stellen dabei 95% der Fälle. Eine Übersicht ermöglicht die Zusammenstellung der Ergebnisse verschiedener Studien durch Wilson et al. (1).
Tabelle 1: Maligne Ursachen des VCSS (1) | |
|---|---|
Tumorart | prozentualer Anteil |
NSCLC | 50 |
SCLC | 22 |
Lymhome | 12 |
Mediastinale Metastasen | 9 |
Keimzelltumore | 3 |
Thymome | 2 |
Mesotheliome | 1 |
Andere | 1 |
Etwa 10 % der Patienten mit einem kleinzelligen Bronchialkarzinom (SCLC) entwickeln ein VCSS, wohingegen die Inzidenz bei dem nicht-kleinzelligen Bronchialkarzinom (NSCLC) weniger als 2 % beträgt (5). Nur 2-4% der Patienten mit einem Non-Hodgkin-Lymphom (NHL) entwickeln ein VCSS . Hier überwiegen die diffus großzelligen und die lymphoblastischen Lymphome mit einer Inzidenz von bis zu 20 % (6). Patienten mit einem primär mediastinal lokalisierten großen B-Zell-Lymphom mit Sklerose, einem Subtyp der diffus großzelligen NHL, weisen eine Inzidenz von VCSS von bis zu 57 % auf (7). In der Regel handelt es sich bei Lymphomen um eine Kompression der Vena cava von außen. Eine Ausnahme stellen die intravaskulär wachsenden angiotrophen Lymphome dar.
Andere maligne Tumoren wie Thymome, primär mediastinale Keimzelltumore und Lymphknotenmetastasen anderer solider Tumore wie z.B. der Mamma sind sehr selten.
Benigne Ursachen machen 15-40% der VCSS aus. Über 50% sind auf eine fibrosierende Mediastinits infolge einer Infektion mit Histoplasma capsulatum (4) oder eine Tuberkulose zurückzuführen. Nokardien führen durch eine kontinuierliche Infektion der Lunge über die Pleura oder cutane Herde zum VCSS. Es gibt vereinzelte Fallberichte über eine fibrosierende Mediastinits bei primär sklerosierender Cholangitis und Sarkoidose (8,9). Die fibrosierende Mediastinitis nach Radiatio kann sich auch noch nach Jahren ausbilden (10). Zu anderen seltenen benignen Ursachen zählen Aortenaneurysmen, Schilddrüsenvergrößerungen und benigne Raumforderungen. Einen wachsenden Anteil an der Inzidenz des VCSS hat die Thrombose aufgrund eines zentralvenösen Dauerverweilkatheters, z.B. eines Ports oder eines Schrittmachers. Als ungewöhnliche Komplikationen sind hierbei Lungenembolien zu fürchten, insbesondere, wenn der Thrombus nicht wandadhärent ist, sondern nur an dem Katheter fixiert ist.
Diagnose
Die Diagnose ergibt sich aus der typischen Klinik. Der charakteristische Befund in der Röntgen-Thorax-Aufnahmen ist meist eine rechts-betonte Verbreiterung des oberen Mediastinums (siehe Abbildung). Die Computertomographie (CT) ist die geeignetste Untersuchungsmethode zur Darstellung der mediastinalen Strukturen. Eine Magnetresonanztomographie empfiehlt sich bei Kontraindikationen gegen eine Kontrastmittelgabe.
Weil das VCSS in 60% der Fälle zu der Erstdiagnose eines Malignoms führt, steht die Histologie-Gewinnung bei einer mediastinalen Raumforderung im Mittelpunkt.
In bis zu 2/3tel der Fälle mit VCSS, denen ein Malignom zugrunde liegt, kann die Diagnose über eine Pleuraergußzytologie oder eine Lymphknotenbiopsie gestellt werden (4). Bei einem Verdacht auf ein NHL kann die Diagnose ggf. auch über eine Knochenmarkbiopsie gesichert werden. Auch die CT-gesteuerte Punktion maligner Raumforderungen stellt eine wenig invasive und mit geringen Komplikationen behaftete Möglichkeit eine histologischen Diagnosesicherung dar (11). Ist die Histologiegewinnung auf diese Weise nicht möglich oder nicht erfolgreich, sind Bronchoskopie, Mediastinoskopie oder eine Thorakoskopie angezeigt. Die Risiken für eine Vollnarkose sind lediglich bei einer trachealen Obstruktion oder einem Perikarderguß erhöht (4).
Vor einer Radiatio sollte unbedingt eine Histologie gewonnen werden, weil in bis zu 40% der Fälle anschließend eine Diagnosesicherung nicht mehr gelingt (12).
Die Histoplasmose muß bei Patienten aus endemischen Gebieten wie dem Mittelwesten der USA, Zentral- und Südamerika, Afrika, Karibik und Südostasien, die sich mit einer klassischen Klinik und CT-Zeichen und/oder positiver Serologie vorstellen, nicht unbedingt über eine Biopsie mit Anlage von Kulturmedien gesichert werden.
Behandlung und Prognose
In einer Untersuchung von 107 Fällen mit VCSS fanden Schraufnagel et al. keine Unterstützung für die lange bestehende Meinung, daß eine Obstruktion der VC einen strahlentherapeutischen Notfall darstellt. So konnte bei diesen Patienten ohne Komplikationen die Diagnostik durchgeführt und das Ergebnis abgewartet werden (4). Einen Notfall stellen jedoch Patienten mit Stridor aufgrund einer Obstruktion der Trachea oder eines Larynxödems dar. Hier ist die Radiatio notfallmäßig indiziert.
Bei einem VCSS aufgrund eines Malignoms hängt die Prognose entscheidend von der Tumorentität, dem Stadium und den Vortherapien ab. Für die Tumoren, die zu den gut auf Chemotherapie ansprechenden gehören, wie das SCLC, Non-Hodgkin-Lymphome und Keimzelltumore, empfiehlt sich die Gabe der für die Tumorentitäten regulären Chemotherapie, die im Mittel nach 1-2 Wochen zu einem Abklingen der Symptome und zu guten Langzeitremissionsraten führt. Bei Patienten mit SCLC im limitierten Stadium oder einem NHL im frühen Stadium konnte ein Überlebensvorteil für eine kombinierte Radiochemotherapie gezeigt werden. Ob ein VCSS für Patienten mit SCLC mit einer besseren oder schlechteren Prognose assoziiert ist, ist unklar. Bei einem zugrundeliegenden NHL scheinen Patienten, bei denen mediastinale Strukturen involviert sind, eine schlechtere Prognose zu haben (6). Bei Patienten mit NSCLC ist das VCSS eindeutig ein schlechter Prognosefaktor, der mit einem mittleren Überleben von nur 5 Monaten einhergeht (13). Dennoch profitieren einige Patienten gut von einer alleinigen Chemotherapie (14) oder einer kombinierten Radiochemotherapie (15).
Ansprechraten und Rezidivrate der Tumore nach Therapie (5) | |||
|---|---|---|---|
Tumorentität | Therapieform | Ansprechrate in % | Rückfallrate in % |
SCLC | Chemotherapie | 84 | 19 |
| Radiatio | 78 | 17 |
| Komb. Radiochemotherapie | 94 | Keine Daten |
NSCLC | Chemotherapie +/- Radiatio | 60 | 17-19 |
Eine Radiatio oder eine Stentimplantation empfiehlt sich bei erfolgloser Chemotherapie, im Rezidiv oder bei Patienten, die für eine Chemotherapie nicht in Frage kommen (16-19).Ein endovaskulärer Stent lindert innerhalb von bis zu 48 Stunden die Symptome. Weder eine komplette Verlegung der VC noch ein Verschluß eines Stents sind eine Kontraindikation (20,21). Eine Symptomlinderung wird in nahezu 100 % der Fälle erreicht. Die im weiteren Verlauf bei etwa 10% der Fälle notwendigen Stentkorrekturen bieten ebenfalls sehr gute Langzeitergebnisse.
Die Datenlage zur thrombolytischen Therapie und Stentimplantation ist unklar. In einem großen systematischen Review war die Morbidität unter Thrombolytika bei Stentimplantation größer (5). Ob bestimmte Stents vorteilhaft sind oder eine Antikoagulation sich empfiehlt ist ebenfalls noch unklar. Wegen seiner guten Verträglichkeit und nur einem geringen Blutungsrisiko wird jedoch die tägliche Gabe von 1 mg Warfarin mit einem Ziel-INR von < 1,6 generell empfohlen (7).
Begleitende Maßnahmen
Kortikosteriode wirken erwiesenermaßen bei Kortikosteroid-sensiblen Malignomen wie z.B. den Non-Hodgkin-Lymphomen. Obwohl keine Studie einen Wirksamkeitsnachweis bei anderen Malignomen erbracht hat, werden sie bei einem ausgeprägten VCSS eingesetzt.
Therapie des VCSS bei benigner Ätiologie
Patienten mit einer benignen Obstruktion der VCS leben länger und sind über einen längeren Zeitraum symptomatisch. In der Regel können sich während des Krankheitsverlaufes jedoch ausreichend Kollateralkreisläufe ausbilden. Dadurch sind endovaskuläre Stentimplantationen oder Bypass-Operationen selten indiziert (23,24). Beide Verfahren zeigen gute Erfolgsraten. In einer Serie von 32 Patienten der Mayo-Klinik wurden drei Patienten mit Stent und 29 mit einem Bypass versorgt. Fünf dieser Patienten mußten wegen einer Stenose oder Okklusion offen chirurgisch revidiert werden. Bei acht Patienten wurde ein Stent eingesetzt. Die Stentimplantation war eine gute Alternative und interferierte nicht mit nachfolgenden chirurgischen Interventionen (24).
Bei einer sekundären Thrombose infolge eines zentralvenösen Dauerverweilkatheters sollte wie bei einer tiefen Beinvenenthrombose zunächst eine effektive Antikoagulation zur Vermeidung einer Lungenembolie durchgeführt werden (25,26). Ist der Katheter funktionsuntüchtig oder benötigt der Patient ihn nicht mehr, sollte er entfernt werden. Für die Indikation zu einer Fibrinolyse liegen keine harten Daten vor. Selten ist eine Intervention nach einer Antikoagulation notwendig. Falls doch, stehen Stent und Bypass-Operation zur Wahl.
Literatur
- Wilson, LD, Detterbeck, FC, Yahalom, J. Clinical practice. Superior vena cava syndrome with malignant causes. N Engl J Med 2007; 356:1862.
- Kishi, K, Sonomura, T, Mitsuzane, K, et al. Self-expandable metallic stent therapy for superior vena cava syndrome: clinical observations. Radiology 1993;189:531-5
- Carlson, HA. Obstruction of the superior vena cava: an experimental study. Arch Surg 1934; 29:669.
- Schraufnagel, DE, Hill, R, Leech, JA, Pare, JA. Superior vena caval obstruction. Is it a medical emergency?. Am J Med 1981; 70:1169.
- Rowell, NP, Gleeson, FV. Steroids, radiotherapy, chemotherapy and stents for superior vena caval obstruction in carcinoma of the bronchus: a systematic review. Clin Oncol (R Coll Radiol) 2002; 14:338.
- Perez-Soler, R, McLaughlin, P, Velasquez, WS, et al. Clinical features and results of management of superior vena cava syndrome secondary to lymphoma. J Clin Oncol 1984; 2:260.
- Lazzarino, M, Orlandi, E, Paulli, M, et al. Primary mediastinal B-cell lymphoma with sclerosis: an aggressive tumor with distinctive clinical and pathologic features. J Clin Oncol 1993; 11:2306.
- Schowengerdt, CG, Suyemoto, R, Main, FB. Granulomatous and fibrous mediastinitis. A review and analysis of 180 cases. J Thorac Cardiovasc Surg 1969; 57:365.
- Narayan, D, Brown, L, Thayer, JO. Surgical management of superior vena caval syndrome in sarcoidosis. Ann Thorac Surg 1998; 66:946.
- Van Putten, JW, Schlosser, NJ, Vujaskovic, Z, et al. Superior vena cava obstruction caused by radiation induced venous fibrosis. Thorax 2000; 55:245.
- Dosios, T, Theakos, N, Chatziantoniou C. Cervical mediastinoscopy and anterior mediastinoscopy in superior vena cava obstruction. Chest 2005;128:1551-6.
- Loeffler, JS, Leopold, KA, Recht, A, et al. Emergency prebiopsy radiation for mediastinal masses: impact on subsequent pathologic diagnosis and outcome. J Clin Oncol 1986; 4:716.
- Martins, SJ, Pereira, JR. Clinical factors and prognosis in non-small cell lung cancer. Am J Clin Oncol 1999; 22:453.
- Citron, ML, Fossieck, BE Jr, Krasnow, SH, et al. Superior vena cava syndrome due to non--small-cell lung cancer. Resolution with chemotherapy alone. JAMA 1983; 250:71.
- Roberts, JR, Bueno, R, Sugarbaker, DJ. Multimodality treatment of malignant superior vena caval syndrome. Chest 1999; 116:835.
- Urruticoechea, A, Mesia, R, Dominguez, J, et al. Treatment of malignant superior vena cava syndrome by endovascular stent insertion. Experience on 52 patients with lung cancer. Lung Cancer 2004; 43:209.
- Oudkerk, M, Kuijpers, TJ, Schmitz, PI, et al. Self-expanding metal stents for palliative treatment of superior vena caval syndrome. Cardiovasc Intervent Radiol 1996; 19:146.
- Nicholson, AA, Ettles, DF, Arnold, A, et al. Treatment of malignant superior vena cava obstruction: metal stents or radiation therapy. J Vasc Interv Radiol 1997; 8:781.
- Baltayiannis, N, Magoulas, D, Anagnostopoulos, D, et al. Percutaneous stent placement in malignant cases of superior vena cava syndrome. J BUON 2005; 10:377.
- Crowe, MT, Davies, CH, Gaines, PA. Percutaneous management of superior vena cava occlusions. Cardiovasc Intervent Radiol 1995; 18:367.
- Courtheoux, P, Alkofer, B, Al Refai, M, et al. Stent placement in superior vena cava syndrome. Ann Thorac Surg 2003; 75:158.
- Boraks, P, Seale, J, Price, J, et al. Prevention of central venous catheter associated thrombosis using minidose warfarin in patients with haematological malignancies. Br J Haematol 1998; 101:483.
- Qanadli, SD, El Hajjam, M, Mignon, F, et al. Subacute and chronic benign superior vena cava obstructions: endovascular treatment with self-expanding metallic stents. AJR Am J Roentgenol 1999; 173:159.
- Kalra, M, Gloviczki, P, Andrews, JC, et al. Open surgical and endovascular treatment of superior vena cava syndrome caused by nonmalignant disease. J Vasc Surg 2003; 38:215.
- Sheikh, MA, Fernandez, BB Jr, Gray, BH, et al. Endovascular stenting of nonmalignant superior vena cava syndrome. Catheter Cardiovasc Interv 2005; 65:405.
- Pieri, S, Agresti, P, Carnabuci, A, et al. Endovascular treatment of benign superior vena cava syndrome: venographic patterns and implications for treatment. Radiol Med (Torino) 2005; 110:359.

