Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik "Unterschenkelgeschwür"
wissenschaftlich begutachtet durch Professor Dr. Malte Ludwig, Chefarzt der Abteilung Angiologie und Phlebologie der Interne Klinik Dr. Argirov, Berg.
von Eberhard Rabe
Inhalt
Für Diagnostik und Therapie venöser Ulzerationen ist das Verständnis der Pathophysiologie, die von der venösen Insuffizienz bis hin zum Ulcus cruris führt, notwendig.
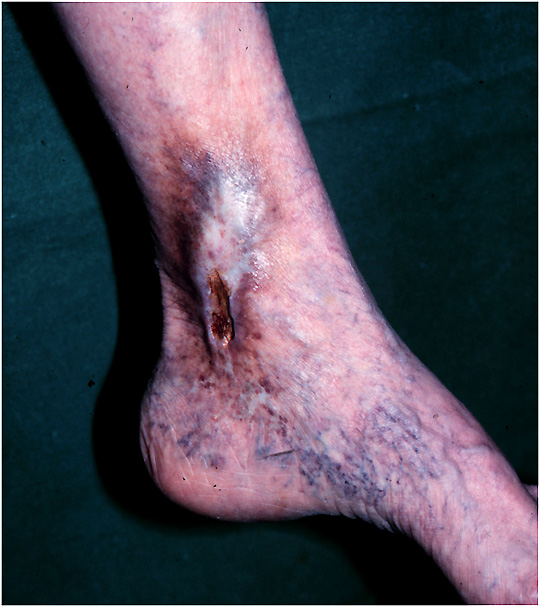
Ulcus cruris Innenknöchelbereich links mit Pigmentierung, Hautatrophie und Corona phlebectatica paraplantaris in der Umgebung.
Pathophysiologie und Klinik
Die chronische venöse Insuffizienz, deren Maximalvariante das Ulcus cruris venosum darstellt, kann sowohl auf dem Boden einer suprafaszialen venösen Insuffizienz wie beispielsweise bei der Varikose aber auch auf dem Boden eines postthrombotischen Syndroms mit subfaszialer Insuffizienz auftreten (3, 7).
Zusätzliche Faktoren wie die arterielle Verschlusskrankheit, das Lymphödem oder orthopädische und neurologische Beinerkrankungen mit Insuffizienz der Muskelpumpe können die venöse Insuffizienz ungünstig beeinflussen.
Im Vordergrund der Entwicklung der chronischen venösen Insuffizienz steht die Klappeninsuffizienz der oberflächlichen und / oder tiefen Beinvenen. Der retrograd gerichtete venöse Blutfluss führt zu einer distalen venösen Volumenüberlastung.
Im Rahmen der Klappeninsuffizienz kommt es zu einer Dysfunktion von Wadenmuskel und Fußpumpen und der damit verbundenen von Partsch beschriebenen ambulatorischen venösen Hypertonie (6). Das bedeutet, auch beim Laufen kann der Patient den im Stehen gemessenen Druck von etwa 90 mm Quecksilbersäule nicht abpumpen und reduzieren, so dass in aufrechter Körperhaltung ein dauerhaft hoher intravenöser Druck im Bein besteht. Diese Druckveränderungen setzen sich auch in die Mikrozirkulation fort. Jünger konnte die ambulatorische kapilläre Hypertonie nachweisen (5).
In der Folge kommt es zu einer venösen und kapillären Dilatation, zu insuffizienten Perforanten und zur Ausprägung von oberflächlichen Venenerweiterungen wie der Chorona phlebectatica paraplantaris im Fußrandbereich. Durch die Vergrößerung der Lücken zwischen den Endothelzellen wird die kapilläre Filtration von Flüssigkeit ins Gewebe hinein erhöht und es kommt zum Ödem. Aber auch Eiweißbestandteile gelangen in die Umgebung der Gefäße und können sich dort als Fibrin ablagern. Insbesondere beim Ulcus cruris wurde dies von Burnand beschrieben (1). Die Extravasation von roten Blutkörperchen führt zu Hämodesiderinablagerungen und zur Pigmentierung.
Im Rahmen der vermehrten kapillären Filtration kommt es auch zur Dekompensation der lymphatischen Funktion, funktionell und langfristig morphologisch mit einem daraus resultierenden Veno-Lymphödem. Wichtiger für die Entwicklung des Ulcus cruris scheint die lokale Hypoxie durch den verlangsamten kapillären Blutfluss zu sein. In diesem Rahmen kommt es zur Aktivierung von weißen Blutkörperchen und Endothelzellen. Die Granulozyten bleiben am Endothel haften und führen zu passageren oder auch permanenten Verschlüssen im Mikrozirkulationsbereich. Dieses sogenannte White-Cell-Trapping wurde von Coleridge-Smith beschrieben (2). Klinisch sichtbares Korrelat dieser Verschlüsse ist die Atrophie blanche.
Durch die Extravasation von Proteinen, Erythrozyten und weißen Blutkörperchen sowie von protelytischen Enzymen und freien Radikalen kommt es insbesondere zu einer chronischen Entzündungsreaktion im Gewebe. Das klinische Bild der Lipodermatosklerose mit zunächst entzündlicher Fibrose von Haut und Unterhautfettgewebe resultiert als Vorstufe des Ulcus cruris.
Sowohl bei Atrophie blanche als auch bei Lipodermatosklerose kommt es zu einem verminderten Gewebe-Sauerstoffpartialdruck und zur Reduktion der Kapillarfunktionen der Haut.
Dieser Zustand kann noch lange kompensiert werden. Wenn aber minimale Traumen, eine lokale Infektion oder eine generelle Aktivierung der Entzündungsreaktion zur zusätzlichen Aktivierung der Granulozyten führen, kann es zur endgültigen Dekompensation der Mikrozirkulation und zum Gewebeuntergang, also zum Ulcus cruris, kommen.
Merke: Zum Bild der Chronischen Venösen Insuffizienz gehören:
|
Diagnostik
Zur Diagnostik und Therapie des venösen Unterschenkelgeschwüres hat die Deutsche Gesellschaft für Phlebologie Leitlinien herausgegeben (3). Das venöse Unterschenkelgeschwür ist durch einen Substanzdefekt in pathologisch verändertem Gewebe des Unterschenkels infolge einer chronischen, venösen Insuffizienz definiert. Als therapieresistent wird es bezeichnet, wenn auch unter optimaler Therapie keine Heilungstendenz in drei Monaten und keine Abheilung in zwölf Monaten zu erreichen ist.
Leitlinie zur Diagnostik und Therapie des Ulcus cruris venosum
Die Baisidiagnostik besteht neben Anamnese und klinischer Untersuchung vor allen Dingen in der Dopplersonographie zum Nachweis von venösen Insuffizienzstrecken, aber auch zum Ausschluss einer arteriellen Beteiligung. Zur weiteren Therapieplanung ist heute die Duplexsonographie als Goldstandard anzusehen. Insbesondere zur Darstellung komplexer postthrombotischer Veränderungen hat aber auch die Phlebographie nach wie vor einen Stellenwert. Im Rahmen der Beurteilung der venösen Funktionsstörung ist neben nichtinvasiven Methoden wie der Photoplethysmographie und der Venenverschlussplethysmographie insbesondere die blutige Venendruckmessung, die Phlebodynamometrie, zu nennen.
Weitere bildgebende Verfahren wie NMR und CT sind nur in Ausnahmefällen indiziert. Im Rahmen der Differentialdiagnose kann es sinnvoll sein, Vaskulitis, Diabetes mellitus und neurologische Probleme weiter abzuklären. Die Thrombophiliediagnostik ist im Einzelfall bei postthrombotischer Ursache indiziert. Auf die Bedeutung der histologischen Untersuchung bei therapieresistenten und auffälligen Ulzerationen wurde bereits hingewiesen.
Therapie
Die Therapie orientiert sich an den pathophysiologischen Ursachen. Im Vordergrund steht die Sanierung des oberflächlichen Venensystems, wenn hier Defekte vorliegen, sowie in der Kompensation der ambulatorischen venösen Hypertonie.
Hierzu stehen verschiedene Möglichkeiten zur Verfügung (2). Basistherapie ist die Kompressionsbehandlung. Wenn möglich auch die Operation des oberflächlichen Venensystems. Klappenrekonstruierende Operationen am tiefen Venensystem sind zurzeit noch speziellen Einzelfällen vorbehalten. Weltweit werden pro Jahr nur circa 100 solcher Operationen durchgeführt. Zum operativen Spektrum gehören auch die Faszienchirurgie mit den endoskopischen Verfahren sowie direkte operative Eingriffe im Ulkusbereich wie Ulkus-Deckung und Shavingbehandlung.
Die medizinische Kompressionstherapie bildet die Grundlage der Ulkustherapie und dient in erster Linie der Kompensation der ambulatorischen venösen Hypertonie. Wegen der Wichtigkeit der Aktivierung der Sprunggelenk- und Muskelpumpen soll sie immer im Zusammenhang mit einer Bewegung und Bewegungstherapie durchgeführt werden.
Als günstig haben sich ein hoher Arbeitsdruck unter dem Verband und ein niedriger Ruhedruck herausgestellt. Hierfür werden vorwiegend kurzzugelastische Materialien verwendet. Mit einer exzentrischen Kompression durch Druckpolster im Ulkusbereich kann die lokale Kompression deutlich verstärkt werden. Es werden vorwiegend mehrlagige Kompressionsverbände als Wechsel- und Dauerverbände eingesetzt. In neuerer Zeit hat sich gezeigt, dass auch mit speziell für die Kompressionstherapie konzipierten Kompressionsstrümpfen wie Ulcertec , Tubulcus oder Ulcercare eine gleich gute Abheilung von komplizierten Ulzerationen erreicht werden kann. Insbesondere bei Patienten mit Bewegungseinschränkung im Sprunggelenk ergänzt die apparative intermittierende Kompression die Therapie.
Kontraindikationen wie die arterielle Verschlusskrankheit sind bei der Kompressionstherapie zu beachten.
Insuffiziente epifasziale Venen, die in Folge von Reflux zu einer distalen Volumenüberlastung führen und deren Entfernung nachweislich zu einer lokalen oder allgemeinen Funktionsverbesserung beiträgt, sollen ausgeschaltet werden.
Bei therapierestistenten Ulzera kommen auch die paratibiale Fasziotomie und die Perforantendissektion eventuell als endoskopische Perforantendissektion mit oder ohne Faszienspaltung in Frage. In einer großen Nachbeobachtungsstudie konnte Glovizcki zeigen, dass auch hierunter die Rezidivrate der venöse Ulzera bei 28 Prozent liegt und dass sie bei postthrombotischen Veränderungen höher liegt als bei Varikose (4).
Das chirurgische Debridement dient der Ulkusreinigung und der Granulationsförderung. Im Anschluss daran kann eine plastische Deckung mit Meshgraft durchgeführt werden. Voraussetzung hierfür ist jedoch ein gutes Granulationsgewebe. Eine Maximalvariante des chirurgischen Debridement stellt die sequentielle Ulkusexcision oder die Shave-Therapie dar. Die so entstandenen Defekte werden wiederum primär oder sekundär plastisch gedeckt.
Indikationen der Shave-Therapie sind das therapieresistente Ulcus cruris mit Dermatoliposklerose. Hierbei werden der Ulkusgrund und die Sklerose schichtweise mit dem Dermatom abgetragen, bis in gut durchblutete Schichten hinein. Anschließend wird mit einem Transplantat gedeckt. Die hierunter beobachtete Heilungsrate liegt etwa bei 70 Prozent. Oberflächlich insuffiziente Venen, insbesondere im Ulkusbereich können auch mit der Sklerosierungstherapie ausgeschaltet werden. Hierbei hat sich in letzter Zeit insbesondere die Verödung mit aufgeschäumten Verödungsmitteln als vorteilhaft erwiesen.
Die Lokaltherapie ist keine ursächliche Behandlung des venösen Ulkus, sondern sorgt lediglich dafür, dass hemmende Einflüsse ausgeschaltet werden und dass eine ungestörte Wundheilung ermöglicht wird.
Anforderungen an den optimalen Wundverband sind:
- die Reduktion von Schmerz und Juckreiz,
- die Aufnahme von Wundsekret, ohne die Wunde auszutrocknen,
- inertes, zumindest hypoallergenes nicht irritatives Material,
- einfacher Verbandwechsel mit größtmöglicher Schonung der Wunde,
- Vermeidung der Abgabe von Verbandbestandteilen an die Wunde,
- Protektion gegenüber physikalischen, chemischen und mikrobiellen Einflüssen,
- Adaptationsfähigkeit an die in der Wunde herrschenden Wundheilungsphasen sowie
- biologische und ökologische Verträglichkeit.
Als geeignete Verbandsstoffe werden hierfür angeboten:
- wirkstofffreie Fettgazen,
- Schaumstoffe z. B. aus Polyurethan,
- Kalziumalginate,
- Hydrogele und Hydrokolloide,
- Silikonschaumstoffe und
- Kollagen-Schwammverbände.
Ein genereller Vorteil einzelner Verbandstoffe im Vergleich ist bislang nicht belegt. Eine optimierte kausale Therapie und eine optimierte Wundauflage reichen in der Regel aus, um die Wundheilung anzuregen und das Ulkus zur Abheilung zu bringen.
Zur Reinigung des Ulkus bei Verbandwechseln sollten keine Antiseptika, sondern z. B. Ringerlösung verwendet werden. Falls erforderlich, soll die Ulkusumgebung zum Schutz vor Mazeration z. B. mit Zinkpaste abgedeckt werden.
Bei hartnäckigen, nicht heilenden Ulzera, nach Ausschöpfung aller anderen therapeutischen Möglichkeiten ist der zusätzliche Einsatz von Wachstumsfaktoren durch die direkte Applikation von einzelnen Faktoren und Faktorkombinationen bzw. indirekt durch Transplantation durch Keratinozytenkulturen zurzeit in klinischer Erprobung.
Exogene Einflüsse können die Wundheilung hemmen. Nekrosen sollten vorwiegend mechanisch abgetragen werden. Bei Infektionen kommen lokale Antiseptika und systemische Antibiotika zur Anwendung. Allergische Reaktionen können lokal Kortikosteroide notwendig machen. Lokale Antibiotika und Farbstoffe wirken granulationshemmend und zum Teil allergisierend und sollten vermieden werden. Die zusätzliche physikalische Therapie umfasst ein intensives kontrolliertes Gehtraining sowie die krankengymnastische Mobilisierung des Sprunggelenkes. Zusätzlich kann manuelle Lymphdrainage und apparative intermittierende Kompression eingesetzt werden.
In Folge der ausgesprochen hohen Rezidivquote sind in Abhängigkeit von der Sanierung des zugrundeliegenden Krankheitsbildes eine konsequente Weiterbetreuung der Patienten und eine konsequente Kompressionstherapie wünschenswert.
Links und Literatur
Leitlinie zur Diagnostik und Therapie des Ulcus cruris venosum
Leitlinien der Deutschen Gesellschaft für Phlebologie (Übersicht)
1. Browse NL, Burnand KG. The cause of venous leg ulcers. Lancet 1982; II:243-245.
2. Coleridge-Smith PD. Deleterious effects of white cells in the course of skin damage in CVI. Int Angiol. 2002;21(2 Suppl 1):26-32.
3. Gallenkemper G, Bulling BJ, Kahle B, Klüken N, Lehnert W, Rabe E, Schwahn-Schreiber C: Leitlinie zur Diagnostik und Therapie des Ulcus cruris venosum. Phlebologie 2000; 29: 97-101.
4. Gloviczki P, Bergan JJ, Rhodes JM, Canton LG, Harmsen S, Ilstrup DM. Mid-term results of endoscopic perforator vein interruption for chronic venous insufficiency: lessons learned from the North American subfascial endoscopic perforator surgery registry. The North American Study Group. J Vasc Surg. 1999;29:489-502.
5. Jünger M, Steins A, Hahn M, Häfner HM. Microcirculatory Dysfunction in Chronic Venus Insufficiency (CVI). Microcirculation 2000; 7:3-12.
6. Partsch B, Mayer W, Partsch H. Improvement of ambulatory venous hypertension by narrowing of the femoral vein in congenital absence of venous valves. Phlebology 1992; 7:101-104.
7. E. Rabe (Hrsg.) Grundlagen der Phlebologie, 3.Auflage Viavital, Köln 2003.

