Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik "Vigilanzminderung ei Leberzirrhose "
von Beate Appentrodt, Christian Rabe und Tilmann Sauerbruch
Inhalt
Klinische Manifestation der Hyponatriämie
Pathogenese der Aszitesentstehung und Hyponatriämie bei Leberzirrhose
Diagnose und Therapie der Hyponatriämie bei Leberzirrhose
Erläuterungen zur Kasuistik
Der Patient stellt sich mit dem Bild einer dekompensierten Leberzirrhose in der Notaufnahme vor. Komplikationen der Leberzirrhose sind bei diesem Patienten die ausgeprägte Aszitesbildung und Ösophagusvarizen Grad II - anamnestisch bislang ohne Blutung.
Das aktuelle, zusätzliche Problem ist nun jedoch eine seit einigen Tagen neu aufgetretene Vigilanzminderung.
Bei einem Patienten mit äthlytoxischer Leberzirrhose im fortgeschrittenen Stadium sollten folgende Differentialdiagnosen erwogen werden: a) Hepatische Enzephalopathie, b) Alkoholdelir bzw. Alkoholentzugsdelir, c) intrakranielle Blutung bei schlechter Gerinnungssituation und Leberzirrhose und d) Elektrolytentgleisungen insbesondere - wie auch bei diesem Patienten – eine ausgeprägte Hyponatriämie.
Auf die anderen neurologischen oder psychiatrischen und internistischen (z.B. Hypercalcämie, Hypoglykämie) Differentialdiagnosen wird hier nicht näher eingegangen; sie dürfen jedoch nicht in der Überlegung fehlen.
Eine hepatische Enzephalopathie kann bei normwertigem Ammoniakspiegel und fehlenden neurologischen Zeichen wie dem „flapping tremor“ und unter entsprechender dauerhafter prophylaktischer Gabe von Laktulose ausgeschlossen werden.
Bei normalem Alkoholspiegel im Blut und fehlenden typischen Zeichen eines Delirs ohne Entzugssymptome ist auch dieses unwahrscheinlich.
Eine intrakranielle Blutung kann ebenfalls durch entsprechende bildgebende Verfahren ausgeschlossen werden.
Es bleibt als Diagnose eine "symptomatische" Hyponatriämie (Serumnatrium < 110 mmol/l) am ehesten verstärkt durch intensivierte diuretische Therapie bei massivem, therapierefraktärem Aszites.
Klinische Manifestation der Hyponatriämie
Die klinische Manifestation einer akuten Hyponatriämie zeigt sich in unterschiedlichen neurologischen Erscheinungsformen wie Kopfschmerzen, Krampfanfälle, Vigilanzminderung.
Bei unserem Patienten ist die neurologische Symptomatik jedoch deutlich milder und macht sich allenfalls durch eine Vigilanzminderung bemerkbar. Dies ist typisch bei Patienten mit Leberzirrhose und Hyponatriämie, da es sich hierbei meist um einen langsam fortschreitenden, chronischen Zustand handelt.
Diagnostik der Hyponatriämie
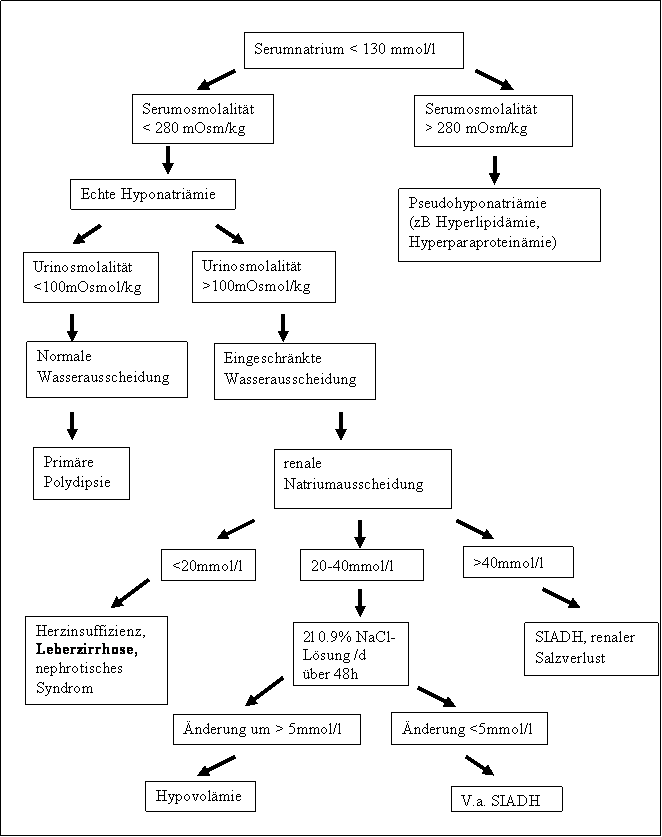
Durch die Bestimmung der Elektrolyte im Blut ist die Diagnose der Hyponatriämie rasch gestellt (Definition <135 mmol/l, bei Leberzirrhose <130mmol/l). Zur weiteren Differenzierung der Hyponatriämie sollten nun im nächsten Schritt die Bestimmung der Serum- und Urinosmolarität, die Urinnatriumkonzentration sowie die Bestimmung weiterer Elektrolyte erfolgen. Bei Leberzirrhose ist am wahrscheinlichsten von einer Verdünnungshyponatriämie auszugehen. Folgende laborchemische Konstellation zeigt sich normalerweise bei der Hyponatriämie: Bei einer Hypoosmolalität im Serum kleiner 280 mOsm/kg, einer Urinosmolalität von größer 100 mOsm/kg und einem Urinnatriumspiegel von kleiner 20 mmol/l liegt der Verdacht auf eine insuffiziente renale Wasserausscheidung nahe. Es ist daher von einer Verdünnungshyponatriämie z.B. zur Gegenregulation einer ausgeprägten splanchnischen Vasodilatation auszugehen, wie es bei der portalen Hypertension der Fall ist.
Pathogenese der Aszitesentstehung und Hyponatriämie bei Leberzirrhose
Ein wesentlicher Faktor der Pathogenese des Aszites ist die unzureichende Natriumexkretion der Niere, welche auf weniger als 10 mmol/ Tag absinken kann. Sie beruht nicht allein auf einer verminderten glomerulären Filtrationsrate, sondern insbesondere auf einer gesteigerten tubulären Rückresorption, vor allem im proximalen Tubulus. Dies entsteht durch eine Aktivierung von volumenregulierenden Hormonen (Renin-Aldosteron-Angiotensin-System (RAAS), ADH, Katecholamine) als Antwort auf ein vermindertes zentrales Blutvolumen bei einer Umverteilung des extravasalen Volumens in das Splanchnikuskompartiment. Die Folge sind eine Hemmung der renalen Durchblutung und Abnahme der glomerulären Filtrationsrate. Diese Störung – zusammen mit dem direkten Effekt der Druckerhöhung in den Lebersinus und dem verminderten onkotischen Druck – führt zu einer vermehrten Sekretion von Lymphe in die Bauchhöhle; d.h. einer Aszitesbildung.
Kommt es zu einer Dekompensation der Leberzirrhose mit Zunahme der portalen Hypertension, führen hochreguliertes RAAS und die renale Gegenregulation zum funktionellen Nierenversagen. Die Unfähigkeit der Nieren zur Ausscheidung von osmotisch freiem Wasser zeigt sich in einer Hyponatriämie und Hypoosmolarität des Blutes, die durch zusätzliche exogene Einflüsse wie eine diuretika-induzierte Natriurese beeinflusst werden kann. Dabei handelt es sich um einen durchaus häufigen Typ der Hyponatriämie, der Verdünnungshyponatriämie (häufig mit Ödemen und Aszites vergesellschaftet), die auf einer Zunahme des Gesamtkörperwassers beruht.
In seltene Fällen kann es bei Patienten mit Leberzirrhose auch zu einem Verlust von extrazellulären Natrium und Wasser, z.B. durch zu intensive diuretische Therapie oder durch Verlust über den gastrointestinalen Trakt kommen. Es entsteht das Bild einer hypovolämen Hyponatriämie (keine oder geringe Ödeme oder Aszitesbildung)(1).
Diagnostik des Aszites
Das führende Symptom des Aszites ist die Bauchumfangsvermehrung. Bei mehr als 1000 ml Aszites kann man diesen im Rahmen der körperlichen Untersuchung durch Perkussion und Klopfschallwechsel bei Lageänderung diagnostizieren. Goldstandard in der Diagnostik ist die abdominelle Sonographie; hierbei können bereits 50-100 ml freie Flüssigkeit nachgewiesen werden. Die Indikation zur Aszitespunktion besteht bei neu aufgetretenem unklaren Aszites, systemischen Infektzeichen, abdominellen Schmerzen, neu aufgetretener bzw. zunehmender hepatischer Enzephalopathie, gastrointestinaler Blutung sowie Nierenfunktionsverschlechterung. Eine Spontan bakterielle Peritonitis (SBP) - eine Infektion des Aszites ohne eindeutigen abdominellen Infektfokus - sollte immer ausgeschlossen werden (Diagnose: segmentkernige Granulozyten >250/µl im Aszites)(1).
Therapie des Aszites
Die Therapie des Aszites zielt auf eine Mobilisation des retinierten Natriums mit der dazugehörigen Flüssigkeitsmenge. Hierbei werden drei Formen von Aszites unterschieden (Grad I (mild), Grad II (moderat) und Grad III (refraktär)) (2,3,4).
Vor Beginn der Therapie sollte der Ausgangsstatus des Patienten erhoben werden (Gewicht, Harnstoff, Kreatinin, Serumelektrolyte sowie Natrium- und Kaliumausscheidung). Während der Behandlung sollten täglich Gewichtskontrollen und zu Beginn alle zwei Tage Kontrollen von Urinvolumen (Natriumausscheidung, Kreatinin) und Serumelektrolyten erfolgen. Bei gleichzeitig vorhandenen peripheren Ödeme darf unter einer diuretischen Behandlung die tägliche Gewichtsabnahme bis zu 1 kg betragen. Fehlen Ödeme, so sollte der Patient höchstens 0,5–0,8 kg Gewicht täglich verlieren. Andernfalls kann es zur einer Verschlechterung der Nierenfunktion kommen (1).
Basismaßnahmen
Eine Bettruhe bei gleichzeitiger Natriumrestriktion (< 2 g/d bzw 88 mmol/d) führt bei der Mehrzahl der Patienten zwar zur begrenzten Aszitesmobilisation, wird aber meist weder vom Patienten noch vom Arzt toleriert, da diese Maßnahmen langwierig und mühsam sind und da nur etwa jeder fünfte Patient ausreichend auf eine solche Maßnahme reagiert.
Diuretikatherapie
Grad I und Grad II-Aszites
Ziel eine diuretischen Therpie ist eine vermehrte renale Natriumexkretion, die gleichzeitig zur Wasserausscheidung führt. Ein Grad II-Aszites lässt sich dabei bei 90% der Patienten innerhalb von 2-3 Wochen komplett mobilisieren. Pfeiler der Therapie ist der Aldosteron-Antagonisten Spironolacton.
Die Monotherapie mit Spironolacton ist der Monotherapie mit einem Schleifendiuretikum oder einem Thiazid überlegen und sollte daher primär eingesetzt werden. Die sofortige Kombinationstherapie von Spironolacton mit einem Schleifendiuretikum verkürzt die Behandlungszeit bis zur Aszitesfreiheit gegenüber dem Stufenschema (Tabelle 1). Eine primäre Kombinationstherapie führt allerdings etwas häufiger zu einer Verschlechterung der Nierenfunktion als die alleinige Gabe von Spironolacton. Nebenwirkungen und Komplikationen der Diuretikatherapie treten bei 20–50% der Patienten auf. Ein verzögertes Absetzen der Diuretika bzw. eine zu hohe Dosierung kann zur schwerer Enzephalopathie und zum funktionellen Nierenversagen (Hepatorenales Syndrom) führen.
Torasemid, ebenfalls ein Schleifendiuretikum, hat gegenüber Furosemid einen leichten Vorteil (längere Halbwertszeit). Xipamid, das kein reines Schleifendiuretikum ist, sondern früh distal peritubulär angreift und weniger auf ausreichende luminale Konzentration angewiesen ist, hat ebenfalls theoretische Vorteile gegenüber dem Furosemid. Bewährt hat sich eine Stufentherapie (Tabelle 1). Parallel zu dieser diuretischen Stufentherapie ist auf eine tägliche salzarme Kost sowie Flüssigkeitsrestriktion (< 2g/d) zu achten.
Grad III-Aszites
Bei etwa 5–15% der Patienten besteht ein sogenannter diuretikarefraktärer Aszites (fehlende Aszitesmobilisation trotz Steigerung der Saluretika bzw. wiederholte Komplikationen unter der diuretischen Therapie). Die Prognose bei diesen Patienten ist schlecht. Bei Patienten mit einem diuretikarefraktären Aszites müssen andere therapeutische Optionen ausgeschöpft werden wie eine wiederholte Aszitespunktion, die Anlage eines transjugulären intrahepatischen Stent-Shunts (TIPS) oder eine Lebertransplantation.
Patienten, die weniger als 5–10 mval Natrium pro Tag ausscheiden, werden nur schlecht auf eine diuretische Therapie ansprechen. Das Ansprechen kann auch über die fraktionelle Natriumelimination (FENa) (%) (FENa= Urinnatrium x Serumkreatinin / Serumnatrium x Urinkreatinin) abgeschätzt werden. Bei einer FENa unter 0,2% ist die Chance einer erfolgreichen saluretischen Therapie gering. Kontraindikationen vor und während einer Diuretikatherapie sind Nierenfunktionsstörungen (Kreatinin >1.5 mg/dl; Elektrolytentgleisung (Natrium < 130 mmol/l, Kalium < 3mmol/l oder > 5 mmol/l und klinische Zeichen der hepatischen Enzephalopathie.
Stufen | Arzneistoff | Dosierung | Gewichtsabnahme (g/Tag) |
1 |
Spironolacton |
100-200 mg/d |
<300 ® Stufe 2 |
2 |
Spironolacton |
100 – 200 mg/d |
<300 ® Stufe 3 |
3 |
Spironolacton |
Bis max. 400mg/d |
<300 ® Stufe 4 |
4 |
Wiederholte Aszitespunktionen oder TIPS-Anlage | ||
Tabelle 1 Stufentherapie des Aszites
Therapeutische Aszitespunktion
Bei Patienten mit ausgeprägtem Aszites, Kontraindikation zur Diuretikatherapie oder Diuretika-resistenten Aszites ist die Parazentese eine gute Alternative zur diuretischen Behandlung. Meist werden 4–6 l Aszites über eine großlumige Nadel abgelassen.
Nach großvolumigen Aszitesparazentesen (> 5 l) kommt es zu einer Verminderung des intravasalen, effektiven Volumens mit entsprechender vasokonstriktorischer Gegenregulation und Verschlechterung der Nierenfunktion (Post-punktionell-induzierte zirkulatorische Dysfunktion (PICD)). Durch die Substitution von Albumin kann diese Gegenregulation verhindert bzw. zumindest vermindert werden. Werden über 5 l Aszites punktiert, so sollten 8 g Albumin pro Liter abgelassenen Aszites substitutiert werden (1,2,3).
Neuere Studien haben gezeigt, dass der Einsatz des Vasokonstriktors Terlipressin nach großvolumiger Aszitespunktion über zwei Tage in einer Dosis von 1 mg 3x/Tag ebenfalls einer renalen zirkulatorischen Dysfunktion entgegenwirken kann (4).
Transjugulärer intrahepatischer Stent-Shunt (TIPS)
Die Anlage eines TIPS senkt den portosystemischen Druckgradienten im Mittel um knapp 50% und führt zu einem langsamen Abfall der Aktivierung des Renin-Aldosteron-Angiotensin-Systems. Gleichzeitig nimmt nach TIPS-Implantation die Natriumexkretion der Niere langsam zu. Es konnte gezeigt werden, dass dadurch bei 60–80% von Patienten mit primär diuretikarefraktärem Aszites dieser nach TIPS-Anlage partiell oder komplett auf die Diuretika-Therapie wieder anspricht.
Die Nachteile einer TIPS-Anlage bestehen in einer Komplikationsrate von etwa 10% (Letalität 1–2%), der Notwendigkeit wiederholter TIPS-Revisionen, um Stenosen (Vorkommen 30–60% innerhalb eines Jahres, bei Verwendung eines beschichteten Stents allerdings seltener) zu verhindern bzw. zu behandeln sowie in der Zunahme der Enzephalopathie bei 10–30% der Patienten. Bei Patienten mit nur mäßig dekompensierter Zirrhose ist die TIPS-Anlage einer wiederholten Aszitespunktion hinsichtlich der Aszitesrezidivfreiheit überlegen und verlängert möglicherweise leicht das Überleben (3,5).
Diagnose der Hyponatriämie bei Leberzirrhose
Hyponatriämie bei Patienten mit Leberzirrhose ist definiert als Reduktion des Serumnatriums kleiner 130 mmol/l. Die Prävalenz der Hyponatriämie kleiner 130 mmol/l bei Patienten mit Leberzirrhose beträgt ca 20%, kleiner 135 mmol/l sogar ca 50% (10).
Hyponatriämie bei Leberzirrhose wurde bereits vor 50 Jahren beschrieben, doch erst seit den 70er und 80er Jahren wurde die klinische und prognostische Bedeutung der Hyponatriämie bei Leberzirrhose erkannt.
Patienten mit Leberzirrhose und einem erniedrigten Serumnatrium (< 130 mmol/l) haben meist eine Verdünnungshyponatriämie, bei gesteigerten RAAS zusammen mit erhöhten ADH-Spiegeln. Zur diagnostischen Sicherung sollten zusätzlich die Serum- und Urinosmolalität sowie die renale Natriumausscheidung gemessen werden. Bei einer Hypoosmolalität im Serum (kleiner 280 mOsm/kg) und einer Urinosmolalität größer 100 mOsm/kg ist von einer insuffizienten renalen Wasserausscheidung auszugehen. Bei einem erniedrigtem Urinnatriumspiegel von kleiner 20 mmol/l ist von einer Verdünnungshyponatriämie, z.B. zur Gegenregulation einer ausgeprägten splanchnischen Vasodilatation, auszugehen, wie es bei der portalen Hypertension der Fall ist (6).
Therapie der Hyponatriämie bei Leberzirrhose
Im folgenden wird nur auf die Therapie der häufigen (hypervolämischen) Verdünnungshyponatriämie bei Leberzirrhose eingegangen (Tabelle 2).
Ziel soll es dabei sein, einen Anstieg der renalen Wasserausscheidung mit Reduktion der Wasserüberladung und Ausgleich der Elektrolyte und der Osmolalität zu bewirken.
Die Gefahr einer erfolgreichen Therapie der Hyponatriämie mit Ausgleich der Natriumkonzentration liegt in einem zu raschen Anstieg des Serumnatriums mit der Gefahr den Entwicklung einer zentralen pontinen Myelinolyse (Demyelinisierung insbesondere im Kleinhirn, in den Basalganglien, in der Capsula interna und im Balken durch Osmose im Rahmen des zu raschen Elektrolytausgleiches). Die Gefahr besteht vor allem postoperativ bei Patienten, die in der Hyponatriämie bei dekompensierter Leberzirrhose Leber-transplantiert werden (11).
Initial muß immer die diuretische Therapie pausiert werden. Weiterhin sollte die Therapie eine Wasserrestriktion von max. 1-1.5 l Flüssigkeit am Tag beinhalten, auch wenn diese Maßnahme nur eine begrenzte Effektivität besitzt. In mehreren klinischen, prospektiven Studien konnte ein Anstieg des Serumnatriums um 5 mmol/l bei 0-26% der Patienten, die eine alleinige Wasserrestriktion einhielten, beobachtet werden (6).
Hypertone Natriumchloridlösung wird in der klinischen Praxis bei sehr schweren, neurologisch symptomatischen Hyponatriämien eingesetzt. Die Effektivität ist jedoch limitiert und kann zu einer Zunahme von Ödemen und Aszites führen. Sie wird daher allgemein nicht empfohlen.
Schließlich konnte - bisher nur in kleinen klinischen Studien - gezeigt werden, dass es durch die Gabe von Humanalbumin zu einem Anstieg des Serumnatriums kommt. Der Hintergrund liegt in einer Volumenexpansion mit Verminderung der Hypovolämie und einer Herunterregulation des RAAS (12).
Die Vaptane
Seit kurzem werden oral aktive V2-Rezeptor-Antagonisten (z.B. Tolvaptan, Satavaptan), die die Wirkung von ADH am V2-Rezeptor selektiv blockieren, bei Patienten mit Leberzirrhose und Aszites klinisch erprobt. V2-Rezeptoren finden sich insbesondere an der basolateralen Membran des Sammelrohres. Sie regulieren den Einbau von Aquaporin3-Kanälen in die luminale Zellmembran. Bei gesunden Personen bewirken Vaptane einen deutlichen Anstieg des Urinvolumens mit einer reduzierten Urinosmalität (7).
Die ersten Studien zeigten bei Patienten mit Leberzirrhose und Aszites ohne Hyponatriämie einen deutlichen Anstieg des Urinvolumens, eine Reduktion der Urinosmolalität und einen Anstieg der renalen Wasserausscheidung (8).
Die nächsten Studien untersuchten den Effekt von Vaptanen bei Leberzirrhose, Aszites und Hyponatriämie: Es zeigte sich ein signifikanter Anstieg des Serumnatriums innerhalb von durchschnittlich 1-2 Wochen nach Therapiebeginn; dabei kam es zu einem mittleren Natriumanstieg um 2 -7 mmol/l. Weiterhin zeigte sich in dieser Patientengruppe eine Normalisierung des Serumnatriums bei 27 bis 54 % der Patienten.
Bislang fehlt dennoch die Erfahrung mit einem langfristigen Einsatz von Vaptanen. Eine klinische, prospektive Studie hat den Effekt von Satavaptan bei Patienten mit Leberzirrhose und Hyponatriämie über die Therapiedauer eines Jahres untersucht (13). Hier fehlen jedoch noch weitere Studien, die einen langfristigen Ansatz haben.
Bei den Nebenwirkungen der Vaptane ist vor allem Durst zu erwähnen, welcher zu einer nicht gewünschten vermehrten Flüssigkeitszunahme führt. Mehrere klinische, doppel-blind angelegte Studien zeigen zusammengefaßt ein vermehrtes Durstgefühl bei den Patienten unter Vaptanen. Weiterhin besteht die seltene Gefahr einer Hypernatriämie unter Vaptanen (Häufigkeit 2-4%), so dass regelmäßige Kontrollen der Elektrolyte und der Nierenretentionsparameter notwendig sind. Das Bild einer zentralen pontinen Myelinolyse hat sich jedoch bislang bei keinem Patienten mit Leberzirrhose, der mit Vaptanen therapiert wurde, gezeigt (6,7,8). Zusammenfassend scheint die Anwendung dieser Substanzen wirksam, aber wahrscheinlich nicht lebensverlängernd zu sein und kann - bei der begrenzten Zahl der Studien - noch nicht als Standard empfohlen werden. Studien, die den langfristigen Effekt und mögliche Nebenwirkungen der Vaptane untersuchen, sollten folgen. Zu erwähnen ist jedoch, noch ein anderer positiver Effekt der Vaptane: klinische, prospektive, multizentrische Studien zeigten eine Reduktion der Aszitesbildung im therapierfraktären Stadium, möglicherweise scheint dies ein weiterer Einsatzbereich der Vaptane in der Therapie der Leberzirrhose zu sein/zu werden (14).
- Wasser- und Natriumrestriktion |
- Absetzen diuretischer Therapie |
- ggf. Albuminsubstittution |
- ggf. Einsatz von Vaptanen |
- bei ausgeprägter, symptomatischer Hyponatriämie: Infusion von hypertoner Kochsalzlösung |
Tabelle 2 Therapie der Hyponatriämie bei Leberzirrhose
Hyponatriämie als Prognosefaktor bei Leberzirrhose
Zur Prognoseabschätzung der Leberzirrhose wird mittlerweile der MELD (Model for End-Stage Liver Disease) Score verwendet. Dabei wird der MELD Score (Skala 6 bis 40, hohe Werte entsprechen einer schweren Leberzirrhose) berechnet auf Basis der Werte Serum-Bilirubin, Serum-Kreatinin und International normalized ratio (INR). Basierend auf diesem MELD Score wurde der Parameter Natrium im Serum als zusätzlicher Faktor in die Kalkulation miteinbezogen: MELD-Na (= MELD – Na – (0.025xMELDx(140-Na))+140. Als Rechenbeispiel ergibt sich für einen Patienten, mit einem MELD Score von 10 und einer Serum-Natriumkonzentration von 125 mmol/l ein MELD-Na-Score von 21. Dies bedeutet, dass der Patient mit einem MELD von 10 jedoch einer Natriumkonzentration von 125 mmol/l das gleich schlechte Überleben hat wie ein Patient mit einem MELD von 21 (15).
Weiterhin sind Patienten mit Hyponatriämie bei Leberzirrhose besonders gefährdet ein Hepatorenales Syndrom (HRS) zu entwickeln (16). Somit ist es im Umkehrschluß auch verständlich, dass viele Patienten mit HRS eine Hyponatriämie aufweisen (9,10).
Literaturverzeichnis
Runyon BA; Practice Guidelines Committee, American Association for the Study of Liver Diseases (AASLD); Management of adult patients with ascites due to cirrhosis – An update Hepatology 2009;49:2087-107
Gines P., Cardenas A, Arroyo V et al.; Management of cirrhosis and ascites. N Engl J Med 2004; 350:1646-54
Gerbes AL.; The patient with refractory ascites. Best Pract Res ClinGastroenterol 2007; 21:551-60
Moreau R., Asselah T., Condar B. et al.; Comparison of the effect of terlipressin and albumin on arterial blood volume in patients with cirrhosis and tense ascites treated be paracentesis : a randomised pilot study. Gut 2002; 50:90-4
Salerno F., Camma C., Enea M. et al.; Transjugular intrahepatic portosystemic shunt for refractory ascites: a meta-analysis of individual patient data Gastroenterology. 2007;133:825-34
Gines P., Guevara M. Hyponatremia in cirrhosis: pathogenesis, clinical significance and management Hepatology 2008; 48:1002-1010
Schrier RW, Gross P, Gheorghiade M et al. Tolvaptan, a selective oral vasopressin V2-receptor antagonist for hyponatremia. N Engl J Med 2006; 355:2099-112
Gines P., Wong F., Watson H., Milutinovic S., del Arbol L.R., Olteanu D. Effects of Satavaptan, a selective vasopressin V2 receptor antagonist on ascites and serum sodium in cirrhosis with hyponatremia: a randomized trial Hepatology 2008; 48: 204-213
Kim R., Biggins S., Kremers W. et al. Hyponatremia and Mortality among patients on the Liver-transplant waiting list N Engl J Med 2008; 359: 1018-26
Angeli P, Wong F, Watson H, Gines P. Hyponatremia in cirrhosis: Results of patient population survey. Hepatology 2006; 44:1535-42
Abbasoglu O. Goldstein RM., Vodapally MS. et al., Liver transplantation in hyponatremic patients with emphasis of central pontine myelinolysis. Clin Transplant 1998; 12:263-269
Mc Cormick PA., Mistry P., Kaye G., Burroughs AK., McIntyre N. Intravenous albumin infusion is an effective therapy for hyponatremia in cirrhotic patients with ascites. Gut 1990; 31: 204-207
Gines P. Wong F. Watson H. Long term improvement of serum sodium by the V2-receptor antagonist satavaptan in patients with cirrhosis and hyponatremia. J Hepatol 2007; 46: A90
Wong F., Gines P. Watson HR., Kujundzic M., Angeli P., Horsmans Y. Effects of a selective vasopressin V2 receptor antagonist, satavaptan on recurrence of ascites after large volume paracentesis. Hepatology 2006, 44 (Suppl.): A180
Londofio MC., Cardenas A., Guevara M. et al. MELD score and serum sodium in the prediction of survival of patients with cirrhosis awaiting liver transplantation. Gut 2007; 56:1283-1290
Gines A., Escorsell A., Gines P., et al. Incidence, predictive factos and prognosis of hepatorenal syndrome in cirrhosis Gastroenterology 1993; 105: 229-236

