Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik "Patientin mit Leistungsknick, Gewichtsabnahme und zunehmenden Beinschmerzen"
von Dirk Sieber, wissenschaftlich begleitet von Malte Ludwig
Inhalt
Diagnose
Bei der Diagnose der Patientin handelte es sich um eine periphere arterielle Verschlusskrankheit beider Beine im Stadium 4 nach Fontaine mit beginnender Gangrän nach rechtsseitigem subakuten Verschluss der A. femoralis superficialis auf dem Boden einer Riesenzellarteriitis der großen Gefäße, die nach ACR-Kriterien auch als Takayasu-Arteriitis Typ 5 des älteren Menschen (Befallsmuster der Takayasu-Arteriitis nach der Konsensuskonferenz von Singapur 1995) klassifiziert werden kann.
Zu dieser komplexen Diagnose veranlassten uns folgende Symptome und Befunde der Patientin:
Die Patientin bot zunächst das Bild einer subakuten peripheren arteriellen Verschlusskrankheit. Hierfür sprachen der über die letzten 3 Monate progrediente Verlauf einer belastungsabhängigen Schmerzsymptomatik (Claudicatio) der Beine mit deutlicher Verschlechterung in den letzten Wochen und aktuell neuen Ruheschmerzen und beginnender Nekrose des lateralen Fußrandes.
An „klassischen“ arteriosklerotischen Risikofaktoren lagen bei der Patientin
- ein Nikotinabusus,
- ein arterieller Hypertonus und
- eine Adipositas
vor.
Der ABI (ankle-brachial-index) betrug am rechten Unterschenkel 0,5, am linken Unterschenkel 0,9. Der ABI wird als Verhältnis des systolischen Blutdrucks in der A. tibialis posterior und anterior der jeweiligen Unterschenkel zu dem am Arm gemessenen systolischen Blutdruck bestimmt (systolischer Blutdruck Bein / systolischer Blutdruck Arm = ABI). Dabei wird der Verschlussdruck der Beinarterien über der Arteria tibialis posterior und Arteria tibialis anterior mit Hilfe einer Blutdruckmanschette und einer CW-Doppler-Stiftsonde gemessen. Normal sind ABI-Werte zwischen 0,9 und 1,2. Während das Heranziehen des niedrigeren ABI-Wertes eines Beines den Vorteil einer höheren Sensitivität für das Vorliegen einer relevanten paVK bietet, hat der höhere Wert bezüglich der Prognose der paVK eine bessere Aussagekraft.
Bei pathologischer ABI-Messung (0,5) am rechten symptomatischen Bein ergänzten wir die apparative Untersuchung der Patientin durch eine Farbduplexuntersuchung der Beinarterien. Hier zeigte sich eine diffuse konzentrische echoarme Wandverdickungen in der beidseitigen A. femoralis communis und superficialis mit rechts konzentrischer filiformer Einengung der A. femoralis superficilialis bis zur A. poplitea und monophasischen Dopplersignalen der A. poplitea und den Unterschenkelarterien rechts mit stark erhöhtem enddiastolischen Fluss als Zeichen segmentaler Verschlüsse der Unterschenkelarterien rechts.
Merke:
An erster Stelle in der apparativen Stufendiagnostik einer peripheren arteriellen Verschlusskrankheit stehen die ABI-Messung und die Farbduplexuntersuchung. Kann mit diesen beiden Untersuchungen der Verdacht auf eine relevante paVK nicht sicher ausgeschlossen werden, dann ist eine CT-/MR-Angiografie oder DSA erforderlich.
Aufgrund des vorliegenden Sonographiebefundes (siehe Abbildung 1) kamen wir zu der Erkenntnis, dass es sich bei dem Gefäßbefund der Patientin nicht um eine gewöhnliche paVK arteriosklerotischer Genese handelte. Die konzentrischen echoarmen Wandverdickungen sind in dieser Form pathognomisch für eine Vaskulitis, im vorliegenden Fall für eine Riesenzellarteriitis.
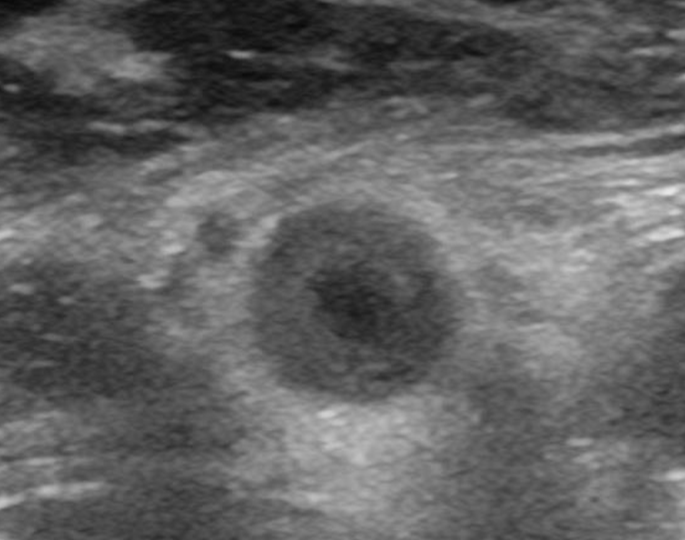
Abbildung 1: Sonogramm der A. femoralis superficialis rechts der in der Kasuistik beschriebenen Patientin mit der für eine Riesenzellarteriitis typischen im Querschnitt konzentrischen echoarmen Wandverdickung mit Halo („Makkaroni-Phänomen“). Alle Fotos: Ludwig/Sieber, Tutzing
Unser Verdacht einer Vaskulitis wurde erhärtet einerseits durch den in der Anamnese berichteten Leistungsknick der Patientin mit Nachtschweißneigung und unbeabsichtigter Gewichtsabnahme von 5 kg, sowie andererseits durch eine beschleunigte Blutsenkungsgeschwindigkeit von 44/62 mm n. W. und einem erhöhten CRP: 2.13 mg/dl (< 0.5).
In der bei kritischer Extremitätenischämie mit Nekrose angefertigten DSA (Abbildung 2b) in Interventionsbereitschaft, zeigten sich für die Großgefäßvaskulitis typische langstreckige filiforme Einengungen der großen Arterien, die differentialdiagnostisch auch beim heute seltenen Ergotismus zur Darstellung kommen können. In der nachträglich angeforderten vor einem Monat angefertigten CT-Angiografie (Abbildung 2a) stellten sich diese Einengungen bereits dar. Auffällig waren in der Computertomografie die geringen arteriosklerotischen Gefäßveränderungen erkenntlich an wenigen typischen röntgendichten Plaques.
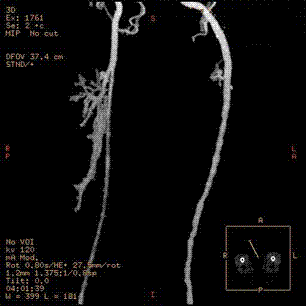
Abbilung 2 a: CTA der OS-Arterien der in der Kasuistik beschriebenen Patientin einen Monat vor der stationären Aufnahme.
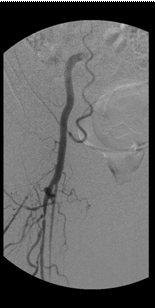
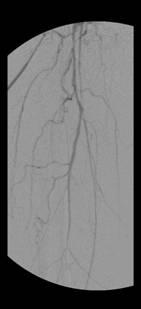
Abbildung 2b: DSA rechtes Bein (hier Darstellung der OS-Arterie) bei stationärer Aufnahme.
Auf dem Boden der Anamnese der Patientin mit ihren typischen Allgemeinsymptomen, der Laborergebnisse insbesondere der beschleunigten BKS und dem erhöhten CRP, sowie der apparativen Befunde mit typischen langstreckigen Einengungen der großen Arterien und konzentrischer echoarmer Wandverdickung im Farbduplex, stellten wir die Diagnose einer Riesenzellarteriitis mit Befall der großen Gefäße.
Differentialdiagnose
Differentialdiagnostisch muss eine Großgefäßvaskulitis zunächst von anderen Vaskulitiden abgegrenzt werden. Dabei hilft zum einen das Befallsmuster (Befall der Aorta und großer Gefäße gegenüber dem Befall mittelgroßer oder kleiner Gefäße bzw. kleinster, nur mikroskopisch darzustellender Gefäße) (Tabelle 1), zum anderen deren Genese (primär/sekundär) (siehe Tabelle 1 und Tabelle 2).
Was die Differentialdiagnose des Extremitätenschmerzes betrifft, so kommen generell folgende Ursachen in Frage (Ludwig M. 1998):
- Arteriosklerose
- Vaskulitis
- Venenthrombose
- Phlegmasia coerulea dolens
- Ergotismus
- Zystische Adventitiadegeneration
- Entrapmentsyndrom
- extravaskulären Ursachen wie Spinalkanalstenose, Muskelerkrankungen oder -traumen, degenerative Gelenkerkrankungen oder Neuralgie, Neuropathie
Einteilung der primären Vaskulitiden gemäß der Chapel Hill Consensus Konferenz (1994):Aorta und große aortale Äste: Mittelgroße Arterien: |
Tabelle 1
Einteilung der sekundären Vaskulitiden gemäß der Chapel Hill Consensus Konferenz (1994):Autoimmunerkrankungen: Infektionen: Malignome: Intoxikationen: Medikamente: |
Tabelle 2
Riesenzellarteriitiden
Definition
Die Riesenzellarteriitiden sind seltene, chronisch-entzündliche Erkrankungen vornehmlich der Aorta und ihrer Hauptäste.
Traditionell werden die
- Arteriitis cranialis
- die Großgefäß-Riesenzellarteriitis
- und die Takayasu-Arteriitis
von einander unterschieden. Sie zeigen histologisch ein ähnliches Bild (Weyand et al. 2003), lassen sich aber meist durch das Befallmuster der Arterien und das Alter der betroffenen Patienten differenzieren.
Die Arteriitis cranialis kommt vorwiegend bei Patienten über 50 Jahre mit Schwerpunkt über 70 Jahre vor.
Die Großgefäßriesenzellarteriitis befällt die Armarterien und / oder die Arterien der unteren Extremität. Dissektionsbildungen mit Bildung von aortalen Aneurysmen sind häufig.
Die Takayasu-Arteriitis ist in der Regel eine Erkrankung junger Frauen unter 40 Jahren mit Befall der Aorta und / oder deren Hauptäste. Eine Beteiligung der Pulmonal-, Nieren oder Koronararterien ist möglich.
Trotz der häufig als Unterscheidungsmerkmal gebrauchten Alterstrennung mit Bevorzugung vorwiegend junger Patientinnen, sind zahlreiche Fälle der Takayasu-Arteriitis des älteren Menschen publiziert worden (Maksimowicz-McKinnon et al. 2003).
Takayasu Arteriitis
Epidemiologie
Die Takayasu-Arteriitis kommt in Asien, Afrika und Südamerika am häufigsten vor. Hiervon sind mehr Frauen (bis zu 90 %) als Männer betroffen. Die Erkrankung beginnt im Jugendalter (ca. 25. Lebensjahr). Die Inzidenz liegt in Europa und Nordamerika bei 1/100.000. Es bestehen deutliche regionale Schwankungen der Inzidenz.
Ätiologie / Pathogenese
Die Ätiologie der Takayasu Arteriitis ist unbekannt. In Japan besteht eine hohe Assoziation zu dem HLA-Marker mit dem Haplotyp A24-B52-DR2. Diese Assoziation ist in anderen Populationen allerdings nicht nachweisbar.
Es handelt sich um eine T-Zell vermitteltete Riesenzellarteriitis. In der Gefäßwand werden dendritische immunkompetente Zellen aktiviert, die eine Invasion von CD4-positive T-Zellen in die Gefäßwand bewirken. Es kommt zu einer Aktivierung von Makrophagen, die interleukinvermittelt in der Adventitia eine systemische Entzündung mit entsprechenden Allgemeinsymptomen hervorrufen. Die Entzündungsreaktion in der Mediamuskelschicht, die durch die Bildung der typischen Riesenzellen charakterisiert ist, geschieht unter der Mitwirkung von Metalloproteinasen (Weyand et al.2003).
Klinik / Anamnese
Fragen nach Allgemeinsymptomen wie Fieber, Nachtschweiß, Myalgien, Arthralgien und Gewichtsverlust als Ausdruck einer akuten Phase und Erfassung von vaskulären Komplikationen als chronische Folge mit ischämischen Claudicatio- oder Ruhe-Beschwerden der Arme oder Beine,
stattgehabten cerebral-neurologischen Ereignissen (TIA/Schlaganfall), myokardiale Ischämiesymptome und pulmonale, hepatische, renale oder gastroenterale Symptome, sowie vorangegangenen Krankheitsschüben.
Laboruntersuchung
BSG, CRP, Differenzialblutbild, CK, GOT, GPT, GGT, Crea, GFR (auch als MDRD) HST,
Gerinnung, TSH, Serumelektrophorese, Rheumafaktoren, ANA, SS-A, SS-B,
c-ANCA, p-ANCA, Antiphospholipid-Antikörper, Lupus-Antikoagulans, Immunfixation, Drogen-Screening, Blutkulturen
Klassifikation
Klassifikationskriterien des American College of Rheumatology (ACR) der Takayasu Arteriitis (Arend et al. 1990):
Die Diagnose einer Takayasu-Arteriitis kann gestellt werden, wenn mindestens 3 der 6 Kriterien erfüllt sind. Gegenüber anderen Vaskulitiden bestehen für die Klassifikationskriterien eine Sensitivität von 90,5 % und eine Spezifität von 97,8 %. |
Tabelle 3
Einteilung des pathologischen Befallsmusters bei der Takayasu-Arteriitis nach der Konsensuskonferenz Singapur 1995:
|
Tabelle 4
Apparative Diagnostik
Farbduplexsonographie
Die Riesenzellarteriitiden sind sonographisch durch konzentrische echoarme Gefäßstenosen mit Halo als Ausdruck eines Wandödems charakterisiert (Czihal 2009). Es findet sich eine glatt begrenzte echoarme arterielle Intima- bzw. Mediaverdickung ohne Kalkeinlagerungen oder Schallschattenbildungen auch als Makkaroni-Phänomen beschrieben mit hoher Spezifität für eine Großgefäß-Riesenzellarteriitis (Sensitivität 69 - 100 % und Spezifität 82-91 % (Schmidt et al. 2008)).
Die CT-/MR-Angiografie ist geeignet zur Darstellung des Befallmusters und Therapieplanung revaskularisierender Maßnahmen.
Die hochauflösenden Magnetresonanztomographie (MRT) zeigt im Nachweis einer Riesenzellarteriitis eine Sensitivität von 69 % im Vergleich zur Farbduplexsonografie mit 67 % und eine vergleichbare Spezifität von beiden Verfahren mit 91 % (Bley et al. 2008).
Die PET (Positronen-Emissions-Tomographie) mit 18F-Fluordesoxyglucose (FDG) kann zur Beurteilung der Krankheitsaktivität eingesetzt werden.
Bei der Patientin gab es in der Anamnese keine zentral-neurologische Symptomatik, insbesondere keine Sehstörungen oder Kopfschmerzen. Die Temporalarterien zeigten sich weder palpabel noch sonographisch verändert. Das Befallsmuster unter Einbeziehung der Arteria Carotis, Arteria subclavia und Becken-Beinarterien stellt sich somit als Riesenzellarteriitis der großen Gefäße oder Morbus Takayasu vom Typ 5 des älteren Menschen dar.
Therapie
Die Therapie der Riesenzellarteriitiden - und hier im speziellen Fall des Morbus Takayasu - richtet sich nach dem klinischen Beschwerdebild und der Krankheitsaktivität. Die Therapie einer Großgefäß-Riesenzell-Arteriitis und Takayasu Arteriitis erfolgt initial mit Kortikoiden zum Beispiel mit Prednisolon 1 mg / kg KG p.o.. Nach klinischer Remission und Rückbildung des CRP < 0,5 mg/dl wird die Prednisolondosis in wöchentlichen 10 mg-Schritten bis auf 30 mg/Tag und dann langsam auf eine Erhaltungsdosis von 5-10 mg/Tag für eine Mindestgesamtdauer von 12 Monaten reduziert.
Im Falle eines akuten schweren Krankheitsbildes mit zerebralen Symptomen und in besonders schweren Fällen der Arteriitis cranialis und Gefahr der Erblindung erfolgt die Therapie mit 500 bis 1000 mg Prednisolon i.v. für 3-5 Tage und wird dann mit Prednisolon 1 mg / kg KG p.o. fortgesetzt (Leitlinien für Diagnostik und Therapie in der Neurologie).
Ergänzend sollte die Gabe von Thrombozytenaggregationshemmern (ASS 100 mg/die oder Clopidogrel 75 mg/die) erfolgen, um die Thrombenbildungen in den stenosierten Arterien zu vermindern. Bei schweren Verlaufsformen mit bereits fortgeschrittenen thrombotischen Verschlüssen kann eine Vollantikoagulation mit zum Beispiel unfraktioniertem Heparin (UFH), niedermolekularem Heparin (NMH) oder Phenprocoumon erforderlich sein.
Eine Osteoporoseprophylaxe mit Vitamin D3 (800 IE/die) unter Cortisonbehandlung ist zu beachten.
Eine Kortikoidmonotherapie führt bei ca. 80 % der Patienten zu einer Remission (el Asri et al 2002). Die Gabe von Methotrexat (7,5-15 mg/Woche) kann zur Einsparung von Glukkokortikoiden oder bei Therapieversagen erfolgen (Tato et al. 2005, Hoffman et al. 1994 u. 1996). Erfahrungen und positive Ergebnisse gibt darüber hinaus mit dem Einsatz von Cyclophosphamid (z. B. Endoxan) und in geringem Umfang mit neueren Substanzen wie zum Beispiel Leflunomid (z. B. Arava).
Unter der immunsuppresiven Therapie nicht regrediente symptomatische Stenosen oder vollständige Gefäßverschlüsse können eine Katheterintervention oder gefäßchirurgische Operation erforderlich machen.
Bei der Bestimmung der Aktivität der Großgefäßvaskultitis zur Diagnosestellung und als Verlaufsparameter gibt es widersprüchliche Untersuchungen:
Ishikawa (Ischikawa et al. 1988) fand bei Patienten mit akuter Takayasu Arteriitis nur in 54 % der Fälle eine BKS (Blutkörpersenkungsgeschwindigkeit)-Erhöhung.
Salvarini (Salvarini et al. 2002) fand für die CRP-Erhöhung (C-reaktives Protein) eine bessere Korrelation zur Krankheitsaktivität als für die BKS.
Untersuchungen über Interleukinspiegel als Verlaufsparameter zeigen vor allem für die Interleukine Il-6 und Il-18 vielversprechende Ergebnisse, ohne dass bereits eine abschließende Empfehlung erteilt werden kann.
Alternativ können MRT- und FDG-PET-Untersuchungen Aufschluss über die Krankheitsaktivität im Verlauf geben, sind aber als Standard auch wegen der hohen Apparativen Kosten nicht etabliert.
Demgegenüber stellt die Farbduplexuntersuchung eine kostengünstige und gut verfügbare Untersuchung zur Verlaufskontrolle dar mit der der Therapieerfolg der Immunsuppressiven Therapie anhand der Wanddickenabnahme und gleichzeitig die resultierende Perfusionsverbesserung kontrolliert werden kann.
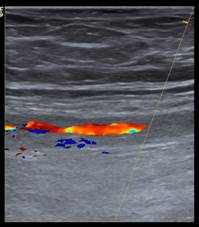
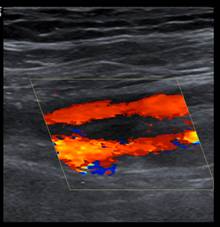
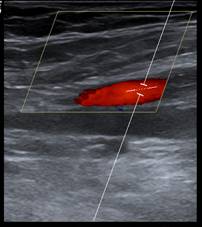
Farbduplexsonografie der Patientin im dargestellten Fall:
Arteria femoralis superficialis rechts; Links: Tag 0; Mitte: Tag 5; Rechts: ambulante Kontrolle an Tag 23 der Kortison-Therapie
Prognose
Bei der Takayasu Arteriitis hängt die Prognose von der Ausprägung der die Erkrankung begleitenden arteriellen Hypertonie, der Herz- oder Pulmonalarterienbeteiligung ab. Rund. ¼ der Patienten mit Takayasu Arteriitis muss dauerhaft behandelt werden.
Die 10 Jahres Mortalität unter Ausschöpfung der konservativen und invasiven Therapiemöglichkeiten beträgt für die Takayasu Arteriitis unter 10 Prozent (Sato et al. 2000).
Literaturverzeichnis
- Arend WP, Michel BA, Bloch DA, Hunder GG, Calabrese LH, Edworthy SM, Fauci AS, Leavitt RY, Lie JT, Lightfoot RW, Masi AT, Mc-Shane DJ, Mills JA, Stevens MB, Wallace SL, Zvaifler NJ (1990): The American College of Rheumatology 1990 criteria for the classification of Takayasu arteritis. Arthr Rheum 33: 1129 – 1134
- Bley TA, Reinhard M, Hauenstein C, Markl M, Warnatz K, Hetzel A et al. Comparison of duplex sonography and high-resolution magnetic resonance imaging in the diagnosis of giant cell (temporal) arteritis. Arthritis Rheum. 2008;58:2574-78.
- Czihal M., Hoffmann U. Die Beteiligung der femoropoplitealen Arterien bei Riesenzellarteriitis: Ergebnisse einer farbduplexsonographischen Studie. 2009
- El Asri A, Tazi-Mezalek Z, Aouni M, Adnaoui M, Mohattane A, Bensaid Y, Maaouni A. (2002): [Takayasu's disease in Morocco. Report of 47 cases], Rev Med Interne 2002 Jan;23(1):9-20
- Hoffman GS, Leavitt RY, Kerr GS, Rottem M, Sneller MC, Fauci AS. (1994): Treatment of glucocorticoid-resistant or relapsing Takayasu arteritis with methotrexate. Arthritis Rheum 1994 Apr;37(4):578-82
- Hoffman GS. Takayasu arteritis: lessons from the American National Institutes of Health experience. Int J Cardiol 1996 Aug;54 Suppl:S99-102
- Ishikawa K (1988): Diagnostic approach and proposed criteria for the diagnosis of Takayasu's arteriopathy. J Amer Coll Cardiol 12: 964 - 972
- Jennette JC, Falk RJ, Andrassy K, Bacon PA, Churg J, Gross WL, Hagen EC, Hoffman GS, Hunder GG, Kallenberg CG, et al. Department of Pathology, School of Medicine, University of North Carolina, Chapel Hill 27599. Nomenclature of systemic vasculitides. Proposal of an international consensus conference. Arthritis Rheum. 1994 Feb;37(2):187-92.
- Ludwig M., Angiologie in Klinik und Praxis (1998), Thieme Verlag
- Maksimowicz-McKinnon K, Clark TM, Hoffman GS. Takayasu arteritis and giant cell arteritis: a spectrum within the same disease? Clin Exp Rheumatol. 2003 Nov-Dec;21(6 Suppl 32):S23-8.
- Salvarani C, Cantini F, Boiardi L, Hunder GG. Polymyalgia rheumatica and giant-cell arteritis. N Engl J Med. Jul 25 2002;347(4):261-71.
- Sato EI, Lima DN, Espirito Santo B, Hata F. (2000): Takayasu arteritis. Treatment and prognosis in a university center in Brazil. Int J Cardiol 2000; 75 (Suppl 1): S163-6
- Schmidt WA, Nerenheim A, Seipelt E, Poehls C, Gromnica-Ihle E. Diagnosis of early Takayasu arteritis by ultrasonography. Rheumatology 2002;41(in press)
- Tatò F, Rieger J, Hoffmann U. Refractory Takayasu's arteritis successfully treated with the human, monoclonal anti-tumor necrosis factor antibody adalimumab. Int Angiol. 2005 Sep;24(3):304-7.
- Weyand C. M., M.D., Ph.D., and Jörg J. Goronzy, M.D., Ph.D., Medium- and Large-Vessel Vasculitis. N Engl J Med 2003;349:160-9.
- Zerebrale Vaskulitis. Leitlinien für Diagnostik und Therapie in der Neurologie; 4. überarbeitete Auflage 2008, S. 654 ff, ISBN 978-3-13-132414-6; Georg Thieme Verlag Stuttgart

