Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik "Pigmentzelltumor"
wissenschaftlich begutachtet durch Professor Dr. Malte Ludwig, Chefarzt der Abteilung Angiologie und Phlebologie der Interne Klinik Dr. Argirov, Berg.
von Uwe Reinhold
Inhalt
Prognose und Stadieneinteilung
- Empfehlungen zu Sicherheitsabständen
- adjuvante Therapie
- palliative Therapie
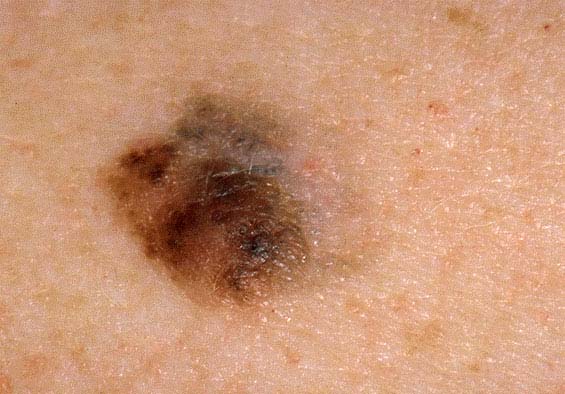
Pigmentierter Hauttumor an der linken Schulter.
Foto: Reinhold
Allgemein
Das maligne Melanom ist ein Tumor, der sich in über 90 % der Fälle als ein Primärtumor der Haut ausgehend von den Melanozyten der basalen Epidermisschichten entwickelt. Darüber hinaus können Melanome aus Pigmentzellen
- der Dermis,
- der Schleimhäute,
- der Leptomeningen,
- der Uvea,
- der Retina,
- der Kochlea,
- dem vestibulären Labyrinth des inneren Ohres sowie
- des Gastrointestinaltraktes entstehen.
Das Melanom ist überwiegend stark pigmentiert. Es können aber auch amelanotische Formen auftreten. Im Verhältnis zur Tumormasse besteht eine frühe Tendenz zur Metastasierung und damit eine ungünstige Prognose.
Die Melanominzidenz nimmt in der weißen Bevölkerung weltweit zu, insbesondere bei stark sonennexponierten hellhäutigen Bevölkerungsgruppen. In Mitteleuropa beträgt die Inzidenz 10 - 15 Fälle pro 100.000 Einwohner und Jahr, in den USA 10-25 Fälle. Die höchsten Inzidenzen mit 50 - 60 Fällen pro 10.000 Einwohner und Jahr weist Australien auf.
Als Risikofaktoren für die Entwicklung eines malignen Melanoms gelten
- Gesamtzahl melanozytärer Naevi (>100 vs. < 10)
- Atypische melanozytäre Naevi (< 5 vs. 0)
- Aktinische Lentigines
- Haarfarbe
- Hauttyp
- Große kongenitale Naevi
- Dysplastisches Naevuszellnaevus-Syndrom
- Familiäre Melanome
- Immunsuppression
- UV-Strahlung
In ca. 20-30 % treten Melanome in Assoziation mit einem vorbestehenden Naevus auf. Insbesondere die sogenannten atypischen Naevi sind als Risikofaktor für das Entstehen eines Melanoms anzusehen. Hierbei handelt es sich um Pigmentmale, die Zeichen der Atypie aufweisen, jedoch klinisch noch nicht sicher einem malignen Melanom zuzuordnen sind.
Diagnostik
Zu den klinischen Merkmalen atypischer Naevi gehören Kriterien der sogenannten ABCDE-Regel, die auch für das maligne Melanom zutreffen:
| A | Symmetrie/Asymmetrie des Aufbaus |
| B | Begrenzung (scharf/unscharf) |
| C | Colorit (homogen/inhomogen) |
| D | Durchmesser (> 5 mm) |
| E | Evolution (Wachstum im Erwachsenenalter) |
Die Summation der Kriterien ergibt eine erhöhte Wahrscheinlichkeit für das Vorliegen eines atypischen Naevus oder auch für ein malignes Melanom.
Zur differentialdiagnostischen Abklärung sollte die Dermatoskopie herangezogen werden. Wie eine Metaanalyse von 22 Studien mit 9004 pigmentierten Hautläsionen zeigt, erreichen Experten im Vergleich zur klinischen Diagnostik mit der Dermatoskopie einen 35%igen Anstieg der diagnostischen Treffsicherheit und damit eine Sensitivität von 89 % und eine Spezifität von 79 % (Kittler et al, 2002). Bei der Beurteilung melanozytärer Hautläsionen ist eine Verlaufsbeobachtung mit der computergestützten Dermatoskopie wertvoll (Kittler et al, 2000). Änderungen der Pigmentmale können so leichter erkannt und bewertet, höher vergrößert und mit digitalen Bildanalyseprogrammen untersucht werden.
Bei der dermatoskopischen Differentialdiagnose von pigmentierten Hautveränderungen empfiehlt sich ein zweistufiges Vorgehen. Im ersten Schritt erfolgt eine Differenzierung zwischen melanozytären und nicht-melanozytären Pigmentveränderungen. Im zweiten Schritt erfolgt die Identifzierung von malignitätsverdächtigen melanozytären Pigmentherden mit Hilfe der Dermatoskopie. In der Hand des Geübten lässt sich die Mehrzahl der Melanomverdachtsdiagnosen durch die bekannten auflichtmikroskopischen Kriterien verifizieren.
Die klinische Verdachtsdiagnose eines Melanoms bedarf der histologischen Bestätigung.
Der verdächtige Tumor sollte möglichst immer komplett vollständig exzidiert und von einem in der histologischen Beurteilung von pigmentierten Hautveränderungen erfahrenen Arzt beurteilt werden. Der histologische Befund sollte folgende Merkmale enthalten:
- den Melanomtyp (superfiziell spreitendes malignes Melanom, noduläres malignes Melanom, Lentigo maligna Melanom, akral-lentiginöses Melanom, nicht-klassifizierbares Melanom, sonstige)
- die Tumordicke in mm nach Breslow
- die Eindringtiefe nach Clark
- Ulzeration
- Regression
- Einbruch in Lmyph-, Blutgefäße oder Perineuralscheiden
- Mikrosatelliten
Mittels hochfrequenter Sonographie (zum Beispiel 20 MHZ-Sonographie) kann eine Tumordickenmessung erfolgen, die für den Sicherheitsabstand bei der Exzision oder für die Durchführung einer Wächterlymphknotenbiopsie von Bedeutung ist.
Prognose und Stadieneinteilung
Während die mediane Tumordicke Anfang der 80er Jahre bei ca. 1,3 mm lag, lag sie in der zweiten Hälfte der 90er Jahre bei 0,8 mm. Damit hat sich die Prognose maligner Melanom verbessert und eine Heilung wird bei ca. 70% aller Patienten durch die primäre Exzision erzielt.
Die wichtigsten prognostischen Faktoren beim primären malignen Melanom ohne Metastasen sind nach neueren Studie folgende:
- die vertikale Tumordicke nach Breslow am histologischen Präparat
- das Vorhandensein einer histologisch erkennbaren Ulzeration
- der Invasionslevel nach Clark
- der Nachweis von Mikrometastasierung in den regionären Lymphknoten durch Wächterlymphknotenbiopsie
- das Geschlecht (signifikant schlechtere Prognose für Männer)
- die Tumorlokalisation (ungünstige Prognose für oberen Stamm, Oberarme, Hals und behaarter Kopf)
Die 10-Jahres-Überlebenswahrscheinlichkeit beträgt bei Patienten mit Satelliten- und In-transit-Metastasen ca. 30-50 % und bei Patienten mit klinisch manifesten regionären Lymphknotenmetastasen ca. 20-40 %. Bei Fernmetastasen ist die Prognose zumeist infaust, die mediane Überlebenszeit ohne Behandlung beträgt nur ca. 6 - 9 Monate, wobei je nach Organbefall eine erhebliche Variationsbreite vorliegt.
Für das maligne Melanom wurde vom AJCC (American joint committee on cancer) 2001 eine neue TNM-Klassifikation und Stadieneinteilung vorgeschlagen, die inzwischen auch von der UICC(International Union against Cancer) akzeptiert worden ist (Balch, 2001).
T-Klassifikation | Tumordicke | weitere Parameter |
|---|---|---|
| Tis | Melanoma in situ | |
| Tx | keine Angabe | Stadium nicht bestimmbar |
| T1 | <= 1,0 mm | a: ohne Ulzeration, Level II-III b: mit Ulzeration oder Level IV oder V |
| T2 | 1,01 - 2,0 mm | a: ohne Ulzeration b: mit Ulzeration |
| T3 | 2,01 - 4,0 mm | a: ohne Ulzeration b: mit Ulzeration |
| T4 | > 4,0 mm | a: ohne Ulzeration b: mit Ulzeration |
N-Klassifikation | Zahl befallener LK | Ausmaß der LK-Metastasierung |
|---|---|---|
| N1 | 1 LK | a: Mikrometastasierung b: Makrometastasierung |
| N2 | 2 - 3 LK | a: Mikrometastasierung |
| N3 | > = 4 LK oder Satelliten oder In-Transit Metastasen |
M-Klassifikation | Art der Fernmetastasierung
| LDH |
|---|---|---|
| M1a | Haut, Subkutan oder Lymphknoten | normal |
| M1b | Lunge | normal |
| M1c | Alle anderen Organmetastasen Jede Art von Fernmetastasierung | normal erhöht |
American Joint Committee on Cancer (AJCC)
International Union against Cancer (UICC)
Therapie
Zur Diagnosesicherung sollte die Exzisionsbiopsie durchgeführt werden. Die Wahl des Sicherheitsabstandes bei der Exzision bzw. Nachexzision von Melanomen gestaltet sich variabel in Abhängigkeit vom Metastasierungsrisiko:
Empfehlungen zu Sicherheitsabständen
| Tumordicke nach Breslow | Sicherheitsabstand |
|---|---|
| In situ | 0,5 cm |
| Bis 2 mm | 1 cm |
| > 2 mm | 2 cm |
Bei Vorliegen zusätzlicher Risikofaktoren bei bis zu 2 mm dicken Melanomen (z.B. Ulzeration, Regressionszeichen im Primärtumor) kann ein Sicherheitsabstand von 2 cm in Erwägung gezogen werden. Die derzeitigen Empfehlungen zur operativen Therapie des Melanoms gründen sich auf prospektiv-randomisierte Studien und internationalen Konsensuskonferenzen.
Durch die Einführung der Wächterlymphknotenbiopsie kommt der elektiven Lymphknotendissektion (ELND) außerhalb von klinischen Studien keine Bedeutung mehr zu. Der Stellenwert der Wächterlymphknotenbiopsie im Hinblick auf die Standards der operativen Versorgung wird weltweit unterschiedlich beurteilt.
Während die Wächterlymphknotenbiopsie in den USA als aussagekräftiges Staging-Instrument mit in die Therapieplanung einfließt, wurde in den britischen Leitlinien zur Versorgung von Melanompatienten erklärt, dass die "Wächterlymphknotenbiopsie für das Staging von Melanompatienten in spezialisierten Zentren in klinischen Studien eingesetzt werden kann, aber bis zum Beweis der Bedeutung der Wächterlymphknotenbiopsie im Hinblick auf eine Verbesserung des Gesamtüberlebens nicht in die Routine überführt werden sollte."
Daher kann die Wächterlymphknotenbiopsie derzeit als ergänzende Staging-Untersuchung, aber nicht als eine therapeutische Maßnahme mit nachgewiesenem Wert im Hinblick auf eine wirksame Verlängerung der Gesamtüberlebenszeit betrachtet werden. Obwohl eine radikale Lymphadenektomie bei Patienten mit Nachweis von Mikrometastasen im Wächterlymphknoten keinen Studien-gesicherten Vorteil bringt, wird derzeit in vielen deutschen Zentren eine komplette Ausräumung der entsprechenden Lymphknotenstation in dieser Situation empfohlen.
Adjuvante Therapie
Prospektiv randomisierte Studien haben gezeigt, dass die adjuvante Therapie mit Interferon-alpha bei Melanompatienten mit einem erhöhten Metastasierungsrisiko (Tumordicke nach Breslow > 1,5 mm und/oder reg. Lymphknotenmetastasen, In-transit Metastasen) einen signifikanten Vorteil für die Behandelten bewirkt.
Im Gegensatz zur adjuvanten Immuntherapie zeigte die systemische adjuvante Chemotherapie in prospektiv randomisierten Studien keinen signifikanten Vorteil für die Patienten. In einer randomisierten EORTC-Studie (European Organisation for Research and Treatment of Cancer)führte auch die Misteltherapie im Vergleich zur unbehandelten Kontrolle zu keiner Verbesserung der Überlebensrate.
Daher sollte eine adjuvante Therapie mit Interferon-alpha allen Patienten mit erhöhtem Metastasierungsrisiko angeboten werden. International wurden verschiedene randomisierte Therapiestudien mit unterschiedlicher Interferon-Dosierung durchgeführt. Für die adjuvante Therapie des Melanoms gibt es Argumente für eine niedrig-dosierte Interferon-alpha-Therapie und alternativ auch für eine Hochdosistherapie nach Kirkwood.
Metaanalysen haben ergeben, dass die adjuvante Interferon-Therapie als Standard anzusehen ist, da sie eine Senkung des Sterbe- und Rezidivrisikos zeigt, ohne dass eine stringente Beziehung zu den Dosierungen erkennbar ist.
European Organisation for Research and Treatement of Cancer (EORTC)
Palliative Therapie
Prinzipielle Indikationen zur systemischen Chemotherapie/Chemoimmuntherapie sind inoperable Rezidivtumoren, inoperable regionäre Metastasen sowie Fernmetastasen. Da die Behandlung überwiegend unter palliativen Gesichtspunkten erfolgt, sind die therapeutischen Bemühungen im Hinblick auf die Erhaltung der Lebensqualität kritisch zu würdigen. Durch eine Kombination von verschiedener Chemotherapeutika oder Kombination von Chemotherapeutika mit Zytokinen konnten im Vergleich zur Monotherapie höhere Remissionsraten erzielt werden, ohne dass hierdurch eine Verlängerung der Gesamtüberlebenszeit erreicht wird.
Die Toxizität der kombinierten Chemotherapien ist im Vergleich zur Monotherapie signifikant erhöht. Allerdings kann der Einsatz der Polychemo- bzw. Polychemoimmuntherapie in Einzelfällen von palliativem Nutzen sein und eine effiziente Behandlung tumorbedingter Symptome bewirken.
Monotherapeutika und Kombinationstherapien beim fernmetastasierten Melanom:
- Dacarbazin
- Temozolomid
- Fotemustin
- Vindesin
- Interferon-alpha
- Interleukin-2
- DTIC (Temozolomid) + Interferon-alpha
- Vindesin + Interferon-alpha
- BHD-Schema
- BOLD-Schema
- DVP-Schema
Strukturierte Nachsorge
In der Versorgung der Melanompatienten spielt die Nachsorge eine wichtige Rolle. Mehr als 80 % aller Rezidive werden in geordneten Nachsorgeuntersuchungen erkannt.
Der Umfang und die Frequenz der Nachsorgeuntersuchungen von Melanompatienten orientieren sich ähnlich wie das therapeutische Vorgehen an den initialen Tumorparametern bzw. dem Tumorstadium. Spätmetastasen sind nicht ungewöhnlich, so dass generell eine Nachsorge über 10 Jahre empfohlen wird.
Dies trägt auch dem erhöhten Risiko des Auftretens von Zweitmelanomen Rechnung. Aufgrund aktueller Studienergebnisse zur Nachsorge des Melanoms aus Deutschland wird eine Modifikation der bisherigen Empfehlungen vorgenommen (Garbe, 2003).
Im Vergleich zu bisherigen Empfehlungen kann der Umfang der Untersuchungen in den Stadien des Primärtumors und besonders bei Melanomen mit weniger als 1 mm Tumordicke reduziert werden. Insbesondere wird eine Reduktion technischer Untersuchungen mit bildgebenden Verfahren in der Nachsorge des frühen Melanoms empfohlen. Bei besonderen prognostischen Risikofaktoren kann allerdings von diesen Empfehlungen abgewichen werden.
Literatur und Links
Balch CM, Buzaid AC, Soong SJ et al. (2001): Final version of the American Joint Committee on Cancer staging system for cutaneous melanoma. J. Clin. Oncol. 19:3635-3648.
Garbe C, Schadendorf D (2003): Malignes Melanom: Neue Daten und Konzepte zur Nachsorge. Dtsch Ärztebl. 100:A1804-1808.
Kittler H, Pehamberger H, Wolff K, Binder M (2000): Follow-up of melanocytic skin lesions with digital epiluminescence microscopy: patterns of modifications observed in early melanoma, atypical nevi, and common nevi. J. Am.Acad. Dermatol. 43:467-476.
Kittler H, Pehamberger H, Wolff K, Binder M (2002): Diagnostic accuracy of dermoscopy. Lancet Oncol. 3:159-165.
Arbeitsgemeinschaft für Dermatologische Onkologie (ADO) der Deutschen Krebsgesellschaft (DKG)
American Joint Committee on Cancer (AJCC)
International Union against Cancer (UICC)
European Organisation for Research and Treatement of Cancer (EORTC)

