Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik "Kleinkind mit Muskelschwäche und Hautveränderungen "
von Gerd Horneff
Inhaltsübersicht
Klinische Manifestationen der Dermatomyositis
Zur Kasuistik
In der vorliegenden Kasuistik handelt es sich um die Diagnose einer juvenilen Dermatomyositis.
Klinische Leitsymptome der juvenilen Dermatomyositis sind die erworbene symmetrische proximal betonte Muskelschwäche und das Auftreten von typischen Hauterveränderungen. Diese bestehen aus einem lila (hellvioletten) Gesichtserythem, im klassischen Fall mit Beteiligung der Haut der Oberlider sowie streckseitig lokalisierten makulopapulösen, manchmal ulzierenden vaskulitischen Effloreszenzen (Abbildung 1 der Kasuistik). Diese Hautläsionen werden Gottron’sche Papeln genannt.
Typisch ist auch eine Rötung des Nagelbetts (Abbildung 2 der Kasuistik). Die pathophysiologische „Ursache“ der klinischen Manifestationen lässt sich anhand der mikroskopischen Untersuchung der Gefäße des Nagelfalzes erkennen. Diese zeigt die Gefäßbeteiligung: Ödem, Dilatationen, Rarefizierung und Blutungen werden beobachtet (siehe Abbildung 3).
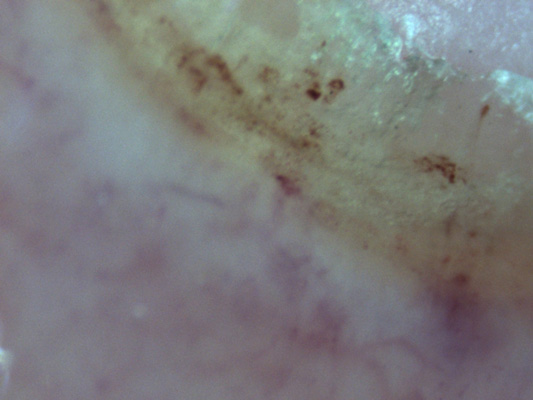
Abbildung 3: Kapillarmikroskopie mit Ödem, fehlender Kappilardurchblutung und
punktförmigen Blutungen.
Labormedizinisch ist die deutliche CK-Erhöhung sehr auffällig gewesen. Auch die Erhöhung der ASAT ist hier wegweisend (Kommentar zum Labor siehe auch unten).
Bildmorphologisch kann eine Muskelentzündung sonographisch (Erhöhung der Echogenität; cave: Strukturveränderungen wie zum Beispiel bei Muskeldystrophie) und kernspintomografisch (Erhöhung der Signalintensität in T2 und FLAIR/STIR-Sequenzen) nachgewiesen werden (siehe Abbildung 4).
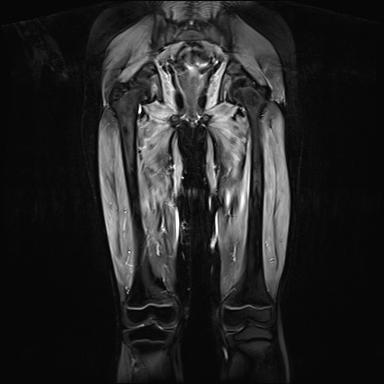
Abbildung 4: Diffus ödematös entzündliche Muskelveränderungen
der Oberschenkel, vereinzelt auch der Glutealmuskulatur.
(MRT in STIR Technik, koronare Schichtung).
Bei klassischer Hautbeteiligung wie im geschilderten Fall wird auf eine Muskelbiopsie verzichtet.
Klinische Manifestationen der Dermatomyositis
Die Erkrankung ist selten. Sie zeigt sich leicht bevorzugt bei Mädchen im Alter von 6 bis 10 Jahren. Die Erkrankung kann rasch oder langsam progredient verlaufend beginnen.
Unspezifische Allgemeinsymptome sind Fieber, Krankheitsgefühl, rasche Ermüdbarkeit und Gewichtsabnahme. Symmetrische, proximal betonte Muskelschwäche und -schmerzen mit Gangunsicherheit (Trendelenburg-Zeichen) weisen auf eine Myositis hin.
Betroffen sind vor allem der Beckengürtel und die Nacken- und Rückenmuskulatur, sodass die Kinder Probleme bekommen, den Kopf gerade zu halten oder diesen im Liegen anzuheben, zu sitzen, zu gehen oder Treppen zu steigen. Das Gower-Zeichen (die Kinder zum Aufstehen „klettern an sich empor“ und das Trendelenburg-Zeichen (Hüftwackeln) sind typisch. In schwersten Fällen ist die Muskulatur von Pharynx, Hypopharynx und Ösophagus betroffen, und es liegen Schluckstörungen vor. Die Muskeleigenreflexe bleiben erhalten. Hauterscheinungen zeigen ¾ aller Patienten.
Typisch sind livide Verfärbung im Gesicht („lilac disease“) mit Lidschwellung, rot-livide vaskulitische Hauterscheinungen über den Fingergelenken (Papeln werden als Gottron’sche Papeln bezeichnet) und Nagelwallödem mit Telangiektasien. Seltener werden auch ein Gingivitis oder Schleimhautulzerationen beobachtet.
Arthralgien und Arthritiden, vaskulitische Ulzerationen der Haut und eine Vaskulitis mit Befall von Herz, Gastrointestinaltrakt, Pankreas, Niere, Lunge und Augen kommen vor und können lebensbedrohlich werden. Langfristig werden Muskelatrophie, Gelenkkontrakturen und Haut-, Unterhaut- und Muskelverkalkungen sowie eine interstitielle Lungenbeteiligung gefürchtet [1]. Im Gegensatz zur Dermatomyositis bei älteren Erwachsenen stellt die juvenile Dermatomyositis kein paraneoplastisches Syndrom dar.
Diagnostisch sind die erhöhten Enzyme, insbesondere die CK wegweisend, die aber nicht immer erhöht ist. Insbesondere bei später Diagnose kann die CK bereits wieder in den Normalbereich abgesunken sein. Weitere Enzymuntersuchungen (ASAT, LDH, Aldolase) sind dann erforderlich. Immunologisch können Autoantikörper, unspezifische ANA sowie muskelspezifische Autoantikörper (Anti-Synthetase, Jo-1, Mi-2, Pm-SCl und weitere) vorliegen, eine Assoziation zu HLA-Antigenen ist beschrieben. Das Autoantikörperprofil ist mit Organbeteiligung assoziiert.
Diagnose
Zur Diagnosestellung werden die Bohan und Peter Kriterien verwendet. Diese schließen Klinik, Enzymerhöhungen (besonders Creatinkinase), Elektromyographie und Muskelhistologie ein. In Fällen mit typischen Hauterscheinungen kann eine Kernspintomographie das EMG oder die Muskelbiopsie ersetzen.
5 diagnostische Kriterien [2]:
- Symmetrische proximale Muskelschwäche (obligat)
- Erhöhung der Creatinkinase (CK) oder anderer muskelspezifischer Enzyme im Serum
- Myopathische Veränderungen im EMG
- Typische entzündliche Hautveränderungen
- Myositisnachweis in der Muskelbiopsie
Die definitive Diagnose erfordert neben der Hautentzündung 2 weitere Kriterien. Bei Vorliegen typischer Hauterscheinungen und MRT-Befunde soll auf eine Biopsie verzichtet werden.
Therapie
Das heutige therapeutische Vorgehen wird durch Evidenzen aus einer klinischen doppelblind-kontrollierten Studie geleitet. Diese zeigt einen eindeutigen Vorteil einer frühen und intensiven Kombinationstherapie aus Kortikosteroiden mit einem Immunsuppressivum (Methotrexat, bei Kontraindikation Cyclosporin A). Bestandteil der leitliniengerechten Therapie der juvenile Dermatomyositis ist nicht Cyclophosphamid.
Die Therapie mit Glukokortikoiden kann oral (Initialdosis 2 mg/kg KG für 2 bis 4 Wochen mit langsamer Dosisreduktion über 2 Jahre) oder mit intravenösen Pulsen von Methylprednisolon (30 mg/kg KG an 3 Tagen) alle 2, später alle 4 Wochen, mit begleitend niedrigen (0,2 mg/kg KG) oralen Glukokortikoiden erfolgen [3,4,5].
Die Kortikosteroidpulstherapie ist zur Vermeidung eines Cushingoid zu erwägen. Allerdings kann der Abstand der Infusionen aufgrund der Muskelschwäche nicht immer auf alle 4 Wochen gestreckt werden. Die bereits initial begonnene begleitende Immunsuppression verbessert Outcome und Steroidverbrauch und hat in offenen Untersuchungen einen günstigen Einfluss auf die Vorbeugung von Verkalkungen. Hautveränderungen erfordern teilweise eine zusätzliche Therapie mit Hydroxychloroquin.
Die Therapie soll sich nicht nach der CK richten, sondern nach der Muskelkraft. Wenn die Diagnose spät gestellt wird, kann sich die CK trotz entzündeter Muskeln normalisieren. Zur Einschätzung der Akivität der Erkrankung ist daher die klinische Untersuchung mit Überprüfung der Muskelschwäche entscheidend.
Prognose
Bei rechtzeitiger Diagnose und Therapie nimmt die Erkrankung in der Regel einen günstigen Verlauf.
Es ist aber keinesfalls richtig, dass der Verlauf in der Regel selbstlimitierend und eine Therapie deshalb nicht erforderlich ist. Eine frühe Kombination mit Kortikoiden und Methotrexat erhöht die Effektivität der Therapie. Insbesondere die Steroidpulstherapie scheint Verkalkungen zu verhindern.
Die Muskelkraft ist der wesentliche klinische Parameter zur Therapiesteuerung. Eine extensive Steroidtherapie kann aber wiederum zur Steroidmyopathie (Muskelatrophie, keine Enzymerhöhung) führen, die nicht immer von der Krankheitsaktivität abgegrenzt werden kann.
Epikrise unseres Patienten
Der Patient erhielt eine pulsatile Therapie mit Kortikosteroiden, begleitend niedrig dosierte orale Steroide und Methotrexat subkutan. Erreicht wurde eine Normalisierung der Muskelkraft in wenigen Monaten. Das Wachstum blieb unbeeinträchtigt. Die Hauterscheinungen bildeten sich mit Narbenbildung zurück. Bei der Kapillarmikroskopie zeigten sich wieder durchblutete Kapillaren mit Verzweigungen als Reparaturerscheinung (siehe Abbildung 5). Die Therapie mit Kortikosteroiden wurde nach 2, die Immunsuppression mit Methotrexat nach 3 Jahren in Remission beendet.

Abbildung 5: Kapillarmikroskopie des gleichen Fingers wie in Abbildung 3. Jetzt sind Kapillaren gut sichtbar.
Verzweigungen gelten als Reparaturphänomen. Alle Abbildungen: Asklepios Klinik, Sankt Augustin
Literatur
- Ravelli A, Trail L, Ferrari C et al. Long-term outcome and prognostic factors of juvenile dermatomyositis: A multinational, multicenter study of 490 patients. Arthritis Care Res 2010;62:63-72
- Bohan A, Peter JB, Bowman RL, Pearson CM. A computer-assisted analysis of 153 patients with polymyositis and dermatomyositis. Medicine 1977; 56:255–86
- Laxer RM, Stein RD, Petty RE. Intravenous pulse methylprednisolone treatment of juvenile dermatomyositis. Arthritis Rheum 1987;30:328-34
- Huber AM, Giannini EH, Bowyer SL et al. Protocols for the initial treatment of moderately severe juvenile dermatomyositis: Results of a Children’s Arthritis and Rheumatology Research Alliance consensus conference. Arthritis Care res 2010;62:219-25
- Ruperto N, Pistorio A, Oliveira S, et al. A randomized trial in new onset juvenile dermatomyositis: prednisone versus prednisone plus cyclosporine versus prednisone plus methotrexate. Arthritis and Rheumatism. 2012; 64 (10 Suppl):S1042–S1043

