Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik "Komplikation nach Venenverweilkanüle "
von Karl Lewalter, René Fussen, Sebastian W. Lemmen
Inhaltsübersicht
Klinische Manifestation und Epidemiologie
Management einer S. aureus Bakteriämie (SAB)
Therapie der S. aureus Bakteriämie (SAB)
In der vorliegenden Kasuistik handelte es sich um eine bakterielle Endokarditis, die als Komplikation einer infizierten Venenverweilkanüle auftrat. Untermauert wird die Diagnose durch die Anamnese, das Fieber des Patienten und die Echokardiographie.
Klinische Manifestation und Epidemiologie
Staphylococcus aureus gehört zu den wichtigsten und häufigsten Erregern sowohl von ambulanten als auch nosokomial erworbenen Infektionen. Während nosokomiale S. aureus-Infektionen oft durch Gefäßkatheter oder Wundinfektionen bedingt sind, ist bei ambulant erworbenen S. aureus-Infektionen die Ursache oft retrospektiv nicht mehr eindeutig zu klären.
Das Spektrum der klinischen Manifestation reicht von oberflächlichen Hautinfektionen (z.B. Furunkel) bis hin zu schweren postoperativen Wundinfektionen beziehungsweise Komplikationen wie Spondylodiszitis, Endokarditis, Pneumonie und Sepsis. Insbesondere bei Knochen- und Gelenksinfektionen besteht ein Zusammenhang mit dem Vorhandensein von Implantaten oder anderen Fremdkörpern. Mit einem Anteil von rund 20 Prozent gehört S. aureus zu den zweithäufigsten Erregern von Bakteriämien und zum häufigsten Erreger von Wundinfektionen [1].
Die Sterblichkeit im Krankenhaus kann bei Patienten auf Intensivstationen bis zu 60 Prozent betragen. Die 30-Tage-Gesamtletalität beträgt etwa 20 Prozent [2]. Unabhängige Risikofaktoren für ein schlechtes klinisches Outcome einer S. aureus-Bakteriämie (SAB) sind [3]:
- Fortgeschrittenes Lebensalter und schwere Grunderkrankungen
- Endokarditis
- Septischer Schock
- Aufnahme auf einer Intensivstation
- Persistierende Bakteriämie
- Unklare Eintrittspforte des Erregers
Der Anteil Methicillin-resistenter S. aureus-Isolate (MRSA) ist variabel. In einer deutschen Kohortenstudie der Jahre 2006 bis 2010 liegt der Anteil von MRSA an S. aureus-Isolaten bei ambulant erworbener Bakteriämie bei 4 Prozent und bei nosokomial erworbener Bakteriämie bei 15 Prozent [2]. Für den Nachweis von MRSA in Blutkulturen oder Liquor besteht seit 2009 eine Meldepflicht. Im Jahr 2014 wurden 3.806 MRSA-Infektionen gemeldet, dies entspricht einer Inzidenz von etwa 5 pro 100.000 Einwohnern pro Jahr [4].
Management einer S. aureus Bakteriämie (SAB)
Der Nachweis von S. aureus in Blutkulturen stellt wie der Nachweis von gramnegativen Erregern oder Candida-Spezies niemals eine Kontamination dar und muss als Infektionserreger immer ernst genommen werden, auch wenn sich ein Patient (noch) in klinisch stabilem Zustand präsentiert oder der Nachweis des Erregers nur in einer von mehreren Blutkulturflaschen vorliegt.
Es muss eine eingehende Anamnese und klinische Untersuchung des Patienten erfolgen, um eine mögliche Eintrittspforte des Erregers zu identifizieren. Allgemein sollte aber auch anamnestisch unbedingt an ambulant durchgeführte Gelenkpunktionen oder Infiltrationsinjektionen zur Schmerztherapie gedacht werden.
Im vorliegenden Fall war die Eintrittspforte des S. aureus der bereits während des vorherigen stationären Aufenthaltes entfernte und infizierte Venenzugang. Staphylococcus epidermis ist ein typischer Erreger von Thrombophlebitiden.
Die Wahrscheinlichkeit für eine Infektion erhöht sich mit zunehmender Liegedauer der Venenverweilkanüle. Deshalb muss die Indikation für intravasale Katheter täglich kritisch hinterfragt werden. Folgende Maßnahmen können zur Reduktion der Staphylokokken bedingten Sepsis beitragen:
- Die tägliche Inspektion der Einstichstelle eines intravasalen Katheters.
- Strikte Einhaltung der Händehygiene.
- Das Abdecken der ZVK Punktionsstelle mit einem Chlorhexidin-Pflaster .
In diesem Zusammenhang sei aber auch erwähnt, dass sich durch die genannten Maßnahmen Staphylococcus aureus Bakteriämien im Rahmen von intravenösen Injektionen nicht zuverlässig verhindern lassen.
Im Falle von Fieber oder dem Verdacht auf auf eine systemische Streuung (wie z. B. Verdacht auf Endokarditis) ist die Abnahme von Blutkulturen erforderlich. Bei Verdacht auf Endokarditis muss zusätzlich eine kardiale Diagnostik mit transösohagealer Echokardiographie erfolgen. Deshalb erfolgte in der vorliegenden Kasuistik die transösophageale Echokardiographie des Patienten (Abbildung) die folgenden Befund ergab:
Global normal systolische Linksventrikuläre Funktion, LA und LAA thrombenfrei, Aorten-, Mitral- und Trikuspidalklappe ohne relevantes Vitium,
Am AML der Mitralklappe kommt eine 1,78 x 1,0 cm messende, flottierende echoarme Zusatzstruktur zur Darstellung, flottierend in Ventrikel und Atrium. An der rechtskoronaren Tasche der Aortenklappe zeigt sich ebenfalls eine flottierende Zusatzstruktur von 0,9 x 0,5 cm Größe.
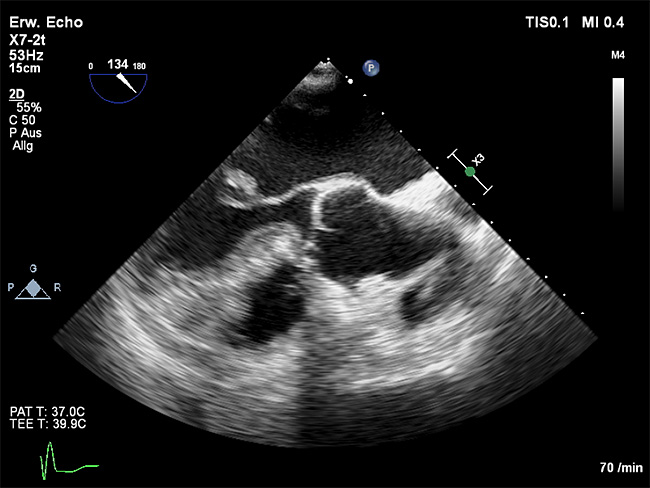
Abbildung: Transösophageale Echodardiographie, Foto: Uniklinik Aachen
Nach Sicherung der Diagnose einer SAB sollte eine Beurteilung der Ausbreitung und des Schweregrades der Infektion erfolgen [3]. Nach dieser Einteilung richtet sich auch die Dauer der antibiotischen Therapie. Kriterien für eine unkomplizierte Erkrankung sind :
- Nachweis eines nicht-tiefsitzenden primären Fokus oder Nachweis einer katheter-assoziierten SAB mit prompter Entfernung des betroffenen Katheters.
- Negative Kontroll-Blutkulturen nach 48-72 Stunden Therapie.
- Entfieberung innerhalb von 48-72 Stunden nach Beginn einer Therapie.
- Ausschluss einer Endokarditis durch transösophageales Echo (TEE).
- Keine dauerhaft implantierten Fremdkörper, wie zum Beispiel Kunstklappen, Gelenkprothesen, Herzschrittmacher oder implantierte Defibrillatoren.
- Kein Anhalt für metastatische Absiedlungen oder Abszesse an anderer Stelle.
Um eine SAB als unkompliziert einstufen zu können, müssen alle diese Kriterien erfüllt sein.
Bei Nachweis einer Endokarditis, einer unklaren Eintrittspforte des Erregers oder bei Nachweis eines tiefsitzenden Fokus oder einer metastatischen Absiedlung, wie zum Beispiel Osteomyelitis, Spondylodiszitis, Empyem oder Meningitis liegt per Definition eine komplizierte SAB vor. In diesem Fall ist das Vorliegen eines einzelnen Kriteriums ausreichend, um eine komplizierte SAB zu definieren.
Therapie der S. aureus Bakteriämie (SAB)
Wichtige Parameter, welche die Therapie beeinflussen, sind die Einteilung in unkomplizierte und komplizierte SAB sowie das eventuelle. Vorhandensein einer Methicillin-Resistenz.
Die Therapiedauer unterscheidet sich je nach Vorliegen einer unkomplizierten (2 Wochen) oder komplizierten SAB (4-6 Wochen). In jedem Fall sollte eine SAB ausschließlich durch eine intravenös verabreichte antibiotische Therapie behandelt werden. Ob im Falle einer unkomplizierten Bakteriämie nach 7 Tagen auf eine orale Therapie umgestellt werden kann, wird zur Zeit in einer multizentrischen Studie untersucht.
Generell ist die bei hochgradigem Verdacht auf eine Staphylococcus aureus bedingte Endokarditis die Antibiotikatherapie einzuleiten.
In der Mehrzahl der Fälle handelt es sich um den Nachweis eines methicillin-sensiblen S. aureus (MSSA). In diesem Fall ist im Antibiogramm des mikrobiologischen Labors Methicillin beziehungsweise Oxacillin als sensibel ausgewiesen. Therapeutikum der ersten Wahl ist in diesem Fall die hochdosierte Gabe von Fluxcloxacillin (Staphylex®). Bei normaler Nierenfunktion sollte eine Tagesdosis von 8 bis 12g (z.B. 4 x 2g oder 6 x 2g) verabreicht werden.
Im Falle einer MRSA-Bakteriämie sollte mit Vancomycin behandelt werden. Empfohlen wird eine Dosierung von 15 mg/kg Körpergewicht alle 12 Stunden. Der Talspiegel sollte zwischen 15-20 µg/ml liegen [5].
In den USA ist das Phänomen des „MIC-creep“, also des langsamen Anstieges der minimalen Hemmkonzentration (MHK) von Vancomycin auf 1,5-2 µg/ml beschrieben worden. Dieses Phänomen spielt momentan in Deutschland nur eine untergeordnete Rolle. Die überwiegende Mehrzahl der MRSA-Isolate ist als voll Vancomycin-sensibel zu betrachten. Dennoch sollte vom mikrobiologischen Labor der MHK-Wert des MRSA-Isolates ausgewiesen werden. Bei einem MHK-Wert von < 1,5 µg/ml verzichten die Autoren auf Anwendung von Vancomycin, insbesondere bei schweren Infektionen.
Als Alternativen zu Vancomycin stehen Linezolid und Daptomycin zur Verfügung. Daptomycin sollte nicht bei einer MRSA-Pneumonie eingesetzt werden, da es durch den Surfactant der Lunge inaktiviert wird. Auch wenn die zuletzt genannten Substanzen regelhaft auch bei MSSA-Nachweisen als sensibel getestet ausgewiesen werden, sollte die Therapie einer Infektion durch MSSA doch bevorzugt mit Flucloxacillin durchgeführt werden.
Die Mitbetreuung von Patienten mit SAB durch einen Infektiologen oder einen infektiologischen Konsiliardienst hat sich in mehreren Studien als vorteilhaft erwiesen. So zeigte sich beispielsweise ein höherer Anteil von Patienten mit Erhalt der Mindesttherapiedauer, häufigerer Echokardiografie oder einer höheren Anzahl an Kontrollblutkulturen. Sowohl die Sterblichkeitsrate während des Krankenhausaufenthaltes als auch die 30-Tage-Sterblichkeit konnten signifikant gesenkt werden [3].
Epikrise unseres Patienten
Bei unserem Patienten bestand der hochgradige Verdacht auf eine Mitralklappenendokarditis, mutmaßlich als Folge der zu kurzen Therapie der MSSA-Bakteriämie vor 14 Tagen. In den erneut abgenommenen Blutkulturen zeigte sich wieder der schon vorbekannte Methicillin-sensible S. aureus in allen 6 abgenommenen Blutkulturflaschen.
Die initial begonnene empirische Therapie mit Piperacillin/Tazobactam wurde nach Erhalt des mikrobiologischen Befundes auf Gabe von Flucloxacillin 12 g/Tag umgestellt. Leitliniengerecht wurde für 5 Tage zusätzlich Gentamicin verabreicht [6]. In der Kontroll-Echokardiografie nach 6 Wochen intravenöser Therapie konnten keine Vegetationen mehr nachgewiesen werden. Da der Patient bei Aufnahme noch über Rückenschmerzen klagte, wurde zum Ausschluss einer Spondylodiszitis noch ein MRT des Rückens mit unauffäligem Befund durchgeführt.
Literatur
- Wisplinghoff H, Bischoff T, Tallent SM et al. Nosocomial bloodstream infections in US-hospitals : analysis of 24,179 cases from a prospective nationwide surveillance study. Clin Inf Dis 2004; 39: 309-318
- Seifert H, Wisplinghoff H, Kaasch A et al. Epidemiologie, Verlauf und Prognose der Staphylococcus-aureus-Bakteriämie : erste Ergebnisse der INSTINCT-Kohorte. Dtsch Med Wochenschr 2008; 133: 340-345
- Rieg S, Kern WV. Die nosokomiale Staphylococcus aureus-Bakteriämie. Krankenhaushygiene up2date 2011; 6: 261-272
- http://www.rki.de/DE/Content/Infekt/SurvStat/survstat_node.html
- Liu C, Bayer A, Cosgrove SE et al. Clinical practice guidelines by the infectious diseases society of America for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children. Clin Inf Dis 2011; 52: 1-38
- Habib G, Hoen B, Tornos P et al. Guidelines on the prevention, diagnosis, and treatment of infective endocarditis. Eur Heart J 2009; 30: 2369-2413

