Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik "Hämorrhagischer Schock bei Hämatemesis - eine dramatische Ursache "
von Benjamin Braun und Martin Reuther
Inhaltsübersicht
Therapie des thorakalen Aortenaneurysmas
Erläuterungen zur Kasuistik
In der vorliegenden Kasuistik handelt es sich um die Diagnose eines rupturierten Aneurysmas der Aorta thoracalis in Höhe des linken A. subclavia-Abganges mit Fistelung in den linken Hauptbronchus und intrathorakalem Hämatom. Diese Diagnose konnte durch die CT-Thoraxuntersuchung, die mit KM durchgeführt wurde, gestellt werden (Abbildung 1)
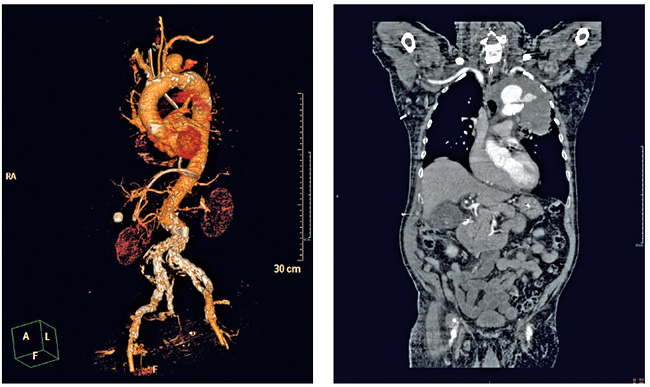
CT-Abdomen/Thorax mit KM des in der Kasuistik beschriebenen Patienten
Abbildung: Praxis Klinik Dr. Hancken in der Klinik Lilienthal
Statt der initial vermuteten Hämatemesis lag primär eine akute, massive Hämoptoe mit enteraler Ingestion des Blutes vor, weshalb sich in der ersten Gastroskopie ein blutgefüllter Magen fand. Das kleine Ulcus ventriculi dürfte lediglich ein Nebenbefund und nicht Ursache der Blutung gewesen sein.
Der hämorrhagische Schock ist eine häufige, schwere Notfallsituation auf Intensivstationen und in Notaufnahmen. Bereits bei dem Verdacht auf eine schwere Blutung sollten Patienten mit mehreren (mindestens zwei) großvolumigen Venenzugängen (mindestens 16 G, grau) versorgt und eine Volumentherapie mit kristalloiden Infusionslösungen begonnen werden. Parallel ist unverzüglich eine Bestimmung des Hämoglobin-Wertes und die Bestellung von Blutkonserven notwendig. Zu beachten ist, dass sich der Hb-Wert in der Anfangsphase einer massiven Blutung durchaus noch im Normbereich befinden und erst im weiteren Verlauf durch Verdünnung drastisch abfallen kann. Der früher häufig benutzte Schockindex (Herzfrequenz / systolischen Blutdruck) ist heute wegen seiner Ungenauigkeit und diagnostischen Unspezifität obsolet. Gerade in der Frühphase einer akuten Blutung kann statt einer Tachykardie eine normale Herzfrequenz oder sogar eine reflektorische Bradykardie vorliegen und dennoch eine kritische Kreislaufsituation bestehen. Bis zur Klärung und Therapie der Blutungsursache und Stabilisierung der Kreislaufverhältnisse sollten Patienten mit schweren Blutungen auf einer Intensivstation überwacht und therapiert werden.
Der peranale Abgang von hellrotem Frischblut bei akuter gastrointestinaler Blutung schließt eine obere gastrointestinale Blutung nicht aus. Da der schwarze Teerstuhl erst durch Fermentierung während eines langsamen Transits durch den Darm entsteht, kann bei massiven Blutverlusten (z.B. Varizenblutungen) die Passage so rasch erfolgen, dass peranal frisches Blut abgesetzt wird.
Die Hauptursachen einer oberen gastrointestinalen Blutung sind Magen- oder Duodenalulcera gefolgt von Ösophagusvarizenblutungen und den erosiv-entzündlichen Erkrankungen von Ösophagus, Magen und Duodenum. Wird durch ein sehr kleines Ulcus eine atypische, submucosal liegende Arterie arrodiert, wird dies als Ulcus Dieulafoy bezeichnet. Durch mechanische Belastung bei Erbrechen können blutende Einrisse am ösophagogastralen Übergang entstehen (Mallory-Weiss-Syndrom). Die Maximalvariante, eine transmurale Ruptur der gesamten Ösophaguswand – das sogenannte Boerhaave-Syndrom – ist sehr selten anzutreffen.
Ursachen eines chronischen Blutverlustes aus dem oberen Gastrointestinaltrakt können auch kleinere Erosionen sein, die bei größeren axialen Hernien durch mechanischen Reiz auftreten (sog. Cameron-Läsionen). Beim GAVE-Syndrom führen oberflächliche Gefäßektasien im Magenantrum (GAVE = gastric antral vascular ectasia) zu Blutverlusten.
Die mit Abstand wichtigsten Ursachen eines peptischen Ulcusleidens sind die Helicobacter pylori (HP)-Infektion sowie die Einnahme von NSAR. Zu beobachten ist mittlerweile eine deutliche Abnahme der Prävalenz der HP-Infektion in Deutschland sowie in anderen entwickelten Ländern, wohingegen die Prävalenz der NSAR-induzierten Ulcera zunimmt. Bei einem Großteil schwer kranker Patienten auf Intensivstation können Schädigungen der Magenschleimhaut in der Mukosaschicht nachgewiesen werden, die sich bei weiterem Fortschreiten zu sogenannten Stress-Ulcera entwickeln können. Diese können im gesamten oberen Gastrointestinaltrakt auftreten und zu Blutungen führen. Ursächlich ist hierfür mutmaßlich eine Imbalance der gestörten protektiven mukosalen Mechanismen und einer Säureüberproduktion. Prophylaktisch werden deshalb Protonenpumpeninhibitoren und H2-Blocker eingesetzt. Beim selteneren Zollinger-Ellison-Syndrom führt ein gastrinproduzierender Tumor (hormonell aktiver neuroendokriner Tumor) zu einer massiven Hypergastrinämie mit dem konsekutiven Auftreten meist multipler Ulcera in Magen und Duodenum. Häufiges Symptom ist auch eine chronische Diarrhoe.
Drüsenkörperzysten (nach dem Erstbeschreiber auch häufig Elster-Drüsenkörperzysten genannt) sind ein bei Gastroskopien häufig zu erhebender Befund und haben keine pathologische Relevanz. Sie treten jedoch mit einer statistisch erhöhten Koinzidenz mit kolorektalen Adenomen und Carcinomen auf, so dass bei Nachweis eine ergänzende Coloskopie empfohlen werden sollte.
Eine wichtige, aber seltene Differentialdiagnose einer oberen gastrointestinalen Blutung bei Patienten mit bekanntem abdominellem Bauchaortenaneurysma ist eine aortoenterische Fistel. Primäre aortoenterische Fisteln entstehen auf dem Boden von arteriosklerotisch-aneurysmatischen Veränderungen der Bauchaorta. Als sekundäre aortoenterische Fisteln werden Fisteln bezeichnet, die nach der operativen oder interventionellen Versorgung abdomineller Aneurysmata auftreten. Hierbei arbeitet sich das feste Fremdmaterial langsam mechanisch durch die Wand des Darmes und führt schließlich zu einer Perforation. Da diese Fisteln meist erst distal des Treitzschen Bandes in der pars horizontalis des Duodenums auftreten, muss die Endoskopie bei gegebenem Verdacht bewusst tief durchgeführt werden. Typische Symptome sind rezidivierende massive Blutverluste, gelegentlich begleitet von Fieber und Sepsis, hervorgerufen durch den Übertritt bakteriell kontaminierten Darminhalts in die Blutbahn.
Hämoptysen können in unterschiedlicher Ausprägung bei verschiedenen Krankheitsbildern auftreten. Typische Ursachen sind Bronchitis, Bronchialcarcinom, Bronchiektasen und die Lungenarterienembolie. Bei Patienten aus Endemiegebieten sollte auch die Tuberkulose bedacht werden.
In der vorliegenden Kasuistik war das rupturierte Aneurysmas der Aorta thoracalis in Höhe des linken A. subclavia-Abganges mit Fistelung in den linken Hauptbronchus Ursache des schwallartigen Bluterbrechens. Dies wurde durch die Bronchoskopie und die CT-Angiographie des Thorax bewiesen.
Eine aortobronchiale Fistel als Ursache einer Hämatemesis / Hämoptoe ist eine extrem seltene Komplikation eines thorakalen Aortenaneurysmas und führt unbehandelt unweigerlich zum Tod. Wichtig sind hier eine frühzeitige Diagnosenstellung, eine adäquate intensivmedizinische Therapie und eine rasche operativ / interventionelle Versorgung.
Aneurysmata werden grundsätzlich dadurch unterschieden, wie viele Wandschichten bei der Aussackung des Gefäßes mitbetroffen sind. So erfolgt abhängig von der Beteiligung der jeweiligen Gefäßwandschichten eine Unterscheidung in echte (A. verum), falsche (A. spurium) und dissezierte (A. dissecans) Aneurysmata. Sobald das Aortenlumen einen Durchmesser von 150 Prozent des durchschnittlichen Durchmessers (adjustiert an Geschlecht, Alter und Körpergröße) überschreitet, spricht man von einem Aneurysma eines Blutgefäßes. Zusätzlich erfolgt abhängig von seiner Lokalisation die Unterscheidung in ein thorakales oder abdominales Aortenaneurysma.
Als Risikofaktoren für Aortenaneurysmen wurden in verschiedenen Studien Rauchen, Bluthochdruck, erhöhtes Alter und das männliche Geschlecht gefunden. 1 bis 4 Prozent der Todesfälle der über 65-jährigen werden auf ein Aneurysma der Aorta thoracalis oder A. abdominales zurückgeführt.
Die klinischen Symptome einer Aortenruptur ergeben sich aus dem mitunter rapiden und massiven Blutverlust als auch der hierdurch verursachten mechanischen Kompression benachbarter Organe.
Im Vergleich dazu stellt sich das nicht-rupturierte thorakale Aneurysma in den meisten Fällen asymptomatisch, selten mit unspezifischer Schmerzsymptomatik (z. B. unspezifischer thorakaler Schmerz) oder Begleitsymptomen durch die mitbetroffenen Organstörungen oder Ausflussbehinderung (Synkopen, Kopfschmerzen, Luftnot, etc.), dann allerdings eher bei einer stattgehabten Dissektion, dar.
Goldstandard in der Diagnostik eines thorakalen Aortenaneurysmas ist nach wie vor die CT-Angiographie und nicht die einfache Röntgen-Thoraxaufnahme. Die CT-Angiographie bietet als einzige Methode einen ausreichenden Überblick über die entsprechende Schädigung als auch Mitbeteiligung anderer Organstrukturen. Auch in unserem Fallbeispiel konnte erst nach erfolgter CT-Diagnostik die Diagnose eines thorakalen Aortenaneurysmas gestellt werden. Weitere diagnostische Methoden können unterstützend hinzugezogen werden (transösophageale Echokardiographie, [Endo]Sonographie, Röntgen), haben jedoch eine wesentlich geringere Aussagekraft gegenüber der CT-Diagnostik.
Therapie des thorakalen Aortenaneurysmas
Unbehandelt führt ein rupturiertes thorakales Aortenaneurysma nahezu immer zum Tode, weshalb bereits ein symptomatisches oder rupturiertes Aneurysma der Aorta umgehend, das asymptomatische Aortenaneurysma entsprechend nach dezidierten Kriterien operiert werden sollte.
Beim asymptomatischen, thorakalen Aneurysmata besteht die ESC-Leitlinien-Empfehlung zur operativen Versorgung eines Aneurysma der Aorta thoracalis ascendens und des Aortenbogens ab einem Durchmesser von ≥ 6,0 cm. Bei der Therapie der Aorta thoracalis descendens wird dem interventionellen Verfahren (TEVAR, Thoracic EndoVascular Aortic Repair) Vorzug gegeben. Auch hier gilt eine Indikation zur Intervention ab einem Durchmesser von ≥ 6,0 cm. Für Patienten mit prädisponierenden Vorerkrankungen oder anatomischen Varianten (z. B. Bindegwebskrankheiten wie dem Marfan-Syndrom, Patientin mit bikuspider Aortenklappe) gelten eigene Empfehlungen mit frühzeitigerer Indikation zur operativen oder interventionellen Therapie.
Die Wahl der optimalen Methode ist jeweils abhängig von Lokalisation und weiteren anatomischen Voraussetzungen. In ausgewählten Fällen werden Operation und interventionelle Therapie (TEVAR) kombiniert in einem Hybrideingriff durchgeführt.
Weiterer Verlauf
Nach Diagnosestellung des rupturierten Aortenaneurysmas wurde die Verlegung des Patienten in ein universitäres Gefäßzentrum organisiert, in dem die kombinierte endovaskuläre sowie gefäßchirurgische Versorgung des Aneurysmas in Hybridtechnik erfolgen konnte.
In der Universitätsklinik erhielt der Patient in mehreren Sitzungen zunächst einen operativen Carotis-Carotis-Subclavia-Bypass (rechts nach links) und anschließend ein Stenting des Aortenbogens mit anschließendem Coiling des Aneurysmasacks. Nach zweimaliger Reintervention bei Minorkomplikationen konnte der Patient im stabilen Allgemeinzustand in unsere Abteilung zurückverlegt werden. Im weiteren Verlauf erholte sich der Patient unter supportiven Maßnahmen gut und wurde in eine Anschlussheilbehandlung verlegt. Mittlerweile konnte er ohne neurologische oder sonstige Residuen wieder in sein häusliches Umfeld entlassen werden. Bei einer Wiedervorstellung des Patienten ½ Jahr nach dem oben genannten Ereignis zeigte er sich nunmehr vollständig genesen und vollständig in sein vorheriges Leben integriert.
Literatur
- Baumann, F., Makaloski, V. & Diehm, N. Internist (2013) 54: 535. doi:10.1007/s00108-012-3217-0
- Heider, P., Wolf, O., Reeps, C. et al. Chirurg (2007) 78: 600. doi:10.1007/s00104-007-1370-0
- MUSSA, Firas F., et al. Acute Aortic Dissection and Intramural Hematoma: A Systematic Review. JAMA, 2016, 316. Jg., Nr. 7, S. 754-763.
- Eur Heart J. 2014 Nov 1;35(41):2873-926.
- MOHLER III ER. Management of thoracic aortic aneurysm in adults. In: UpToDate, Post TW (Ed). UpToDate, Waltham, MA.

