Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik "Strangförmige Verhärtungen im Bereich der Mamma"
von Fabian Brenninger, Georg von Bodman, Jürgen Pache
Inhaltsübersicht
Ventrikelseptumdefekt nach Myokardinfarkt
Metabolische (Kontraktions-)Alkalose mit konsekutiver Hypokaliämie
Einleitung
Verantwortlich für die Beschwerden unserer Patientin zeigten sich zum einen ein Ventrikelseptumdefekt (VSD) zum anderen eine metabolische Alkalose. Der VSD entstand durch eine Nekrose im Rahmen des Myokardinfarktes. Die Alkalose war durch das rezidivierende Erbrechen sowie eine hochdosierte diuretische Therapie über mehrere Wochen induziert.
Ventrikelseptumdefekt nach Myokardinfarkt
Epidemiologie
Ein Ventrikelseptumdefekt (VSD) tritt infolge von ca. 0,2 Prozent aller Myokardinfarkte auf. Vor Etablierung zunächst der Thrombolyse und später der PCI und des Stentings lag die Zahl der Betroffenen um das Zehnfache höher. Die Mortalität stieg in der gleichen Zeit an, was eher durch das frühere Auftreten der Komplikation sowie die Häufung komplexer Defekte zu erklären ist.
Pathophysiologie
Das Risiko für die Entstehung eines VSD ist vor allem dann gegeben, wenn ein transmuraler, extensiver Infarkt subakut behandelt wird. Dabei kann es zu einer konsekutiven Nekrose und Ruptur des minderperfundierten Septumabschnittes kommen. Aufgrund der Druckdifferenz in den Ventrikeln entsteht ein Links-Rechts-Shunt und infolge dessen eine pulmonale Hypertonie und eine Rechtsherzbelastung. Das Ausmaß des Shunts wird neben der Größe des Defektes durch physiologische Parameter bestimmt (ein pulmonaler Hochdruck sowie eine Mitralklappeninsuffizienz vermindern, ein hoher systemischer Gefäßwiderstand erhöhen das Shunt-Volumen).
Bedeutsame Risikofaktoren sind fortgeschrittenes Alter, weibliches Geschlecht, eine 1-Gefäß-Erkrankung der RIVA oder RCA, die fehlende Kollateralisierung zwischen den Koronarien sowie ein Vorderwand-Infarkt. Unsere Patientin wies all diese Merkmale auf.
Klinik
Es kommt klassischerweise zu einem plötzlichen Wiederauftreten der Beschwerden 2 bis 14 (durchschnittlich 2,6) Tage nach dem Infarkt. Auskultatorisch fällt häufig ein holosystolisches Geräusch über dem gesamten Herzen mit punctum maximum über dem Erb'schen Punkt auf. Das EKG kann Zeichen einer Ischämie in dem betroffenen Abschnitt zeigen (Abbildung 1: ST-Hebungen in V1-V4). Je nach Ausmaß der Rechtsherzbelastung treten Dyspnoe, Pleuraergüsse und periphere Ödeme auf.
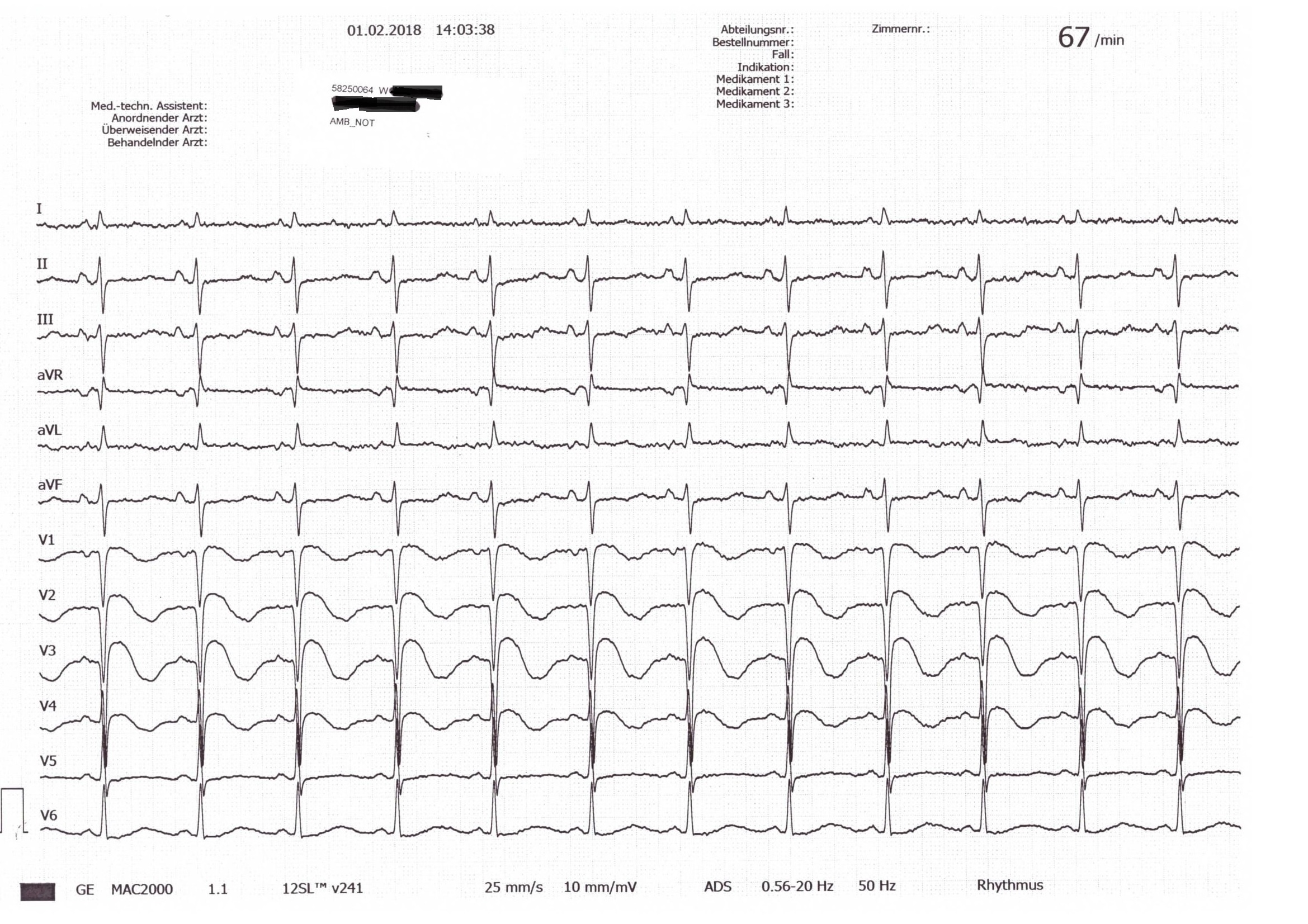
Abbildung 1: EKG der Patientin bei Aufnahme. Quelle: Benedictus Krankenhaus, Tutzing
Diagnostik
Zur Diagnostik des VSD können die Anamnese und Klinik, der Auskultationsbefund sowie das EKG eine Hilfestellung leisten. Lange Zeit war die Rechtsherzkatheteruntersuchung mit Messung des pulmonalarteriellen Drucks das Mittel der Wahl. Heute gilt die (transthorakale) Echokardiographie als Goldstandard. Im Rahmen dieser können die Funktion der Ventrikel, Größe und Lage des Defektes sowie das Ausmaß des Shunts gemessen und mögliche Differentialdiagnosen ausgeschlossen werden. So kommen hierfür in erster Linie der häufiger auftretende und mit einer hohen Letalität einhergehende Myokardriss sowie der seltenere, jedoch teils mit einem VSD kombinierte Papillarmuskel-Abriss in Frage. Zur genaueren Beurteilung des Defektes, des Ausmaßes der umgebenden Nekrose und der Quantifizierung des Shuntvolumens kann zusätzlich ein Cardio-MRT durchgeführt werden, wie es auch im Falle unserer Patientin geschehen ist (siehe Abbildung 2)
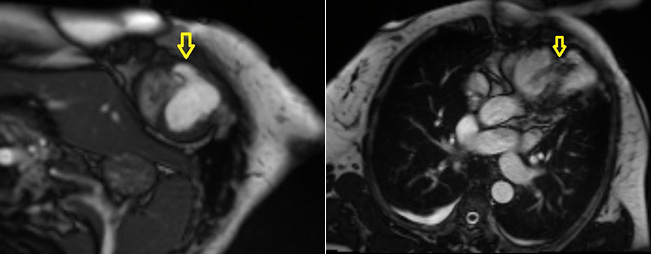
Abbildung 2: Magnetresonanztomographie des Herzens der Patientin der vorliegenden Kasuistik : deutlich ist der Links-Rechts-Shunt im Bereich des VSD erkennbar. Quelle: Benedictus Krankenhaus Tutzing
Prognose
50 Prozent der Betroffenen versterben innerhalb der ersten sieben Tage nach Ausbildung des Defektes. Ohne eine operative Therapie besteht eine Mortalität von 94 Prozent innerhalb von 30 Tagen; mit operativer Sanierung beträgt sie 47 Prozent.
Die Mortalität ist zudem abhängig von
- der Art des Infarktes,
- dem Alter der Patientin oder des Patienten,
- vorbestehenden Komorbiditäten,
- der kardiovaskulären Stabilität und Kompensationsfähigkeit
- sowie dem gewählten OP-Zeitpunkt.
Hierbei gilt, dass eine Latenz von mindestens drei Wochen zwischen Entstehung und Verschluss des Defektes sich günstig auf die Prognose auswirkt, da eine Heilung des nekrotischen Gewebes und somit ein stabileres Einbringen von Nähten möglich ist.
Therapie
Bei Kontraindikation für eine Operation oder zur Überbrückung bis zum optimalen Interventionszeitpunkt ist ein konservativer Therapieansatz möglich. Im Vordergrund stehen hierbei die Kreislaufstabilisierung (z.B. durch Katecholamine und Volumenkontrolle) sowie das Abwenden eines Pumpversagens (etwa mit Hilfe einer intraaortalen Ballonpumpe oder durch Nachlastsenkung). Wenn nicht bereits vor Entstehung des Defektes geschehen, so sollte vor der Operation eine Koronarangiographie durchgeführt werden. So können interventionsbedürftige Koronarstenosen oder Klappendefekte detektiert und im Rahmen der VSD-Operation mitversorgt werden.
Die operative Therapie wird unter Verwendung der Herz-Lungenmaschine durchgeführt. Die Ventrikulotomie erfolgt durch die Stelle des ursprünglichen Infarktes, um postoperative Myokardschäden und somit Funktionseinschränkungen möglichst gering zu halten. Über diesen Zugang erfolgt anschließend der Verschluss des Defekts mittels Implantatation eines Dacron-Patches.
Die 5-Jahresüberlebensrate betrug in englischen Studien 60 Prozent, die über 10 Jahre 31 Prozent. Bei 17 Prozent der operativ Versorgten war ein Residuum des Defektes nachweisbar. Die große Mehrzahl wies nach Operation eine NYHA Funktionsklasse von I oder II (keine Beschwerden in Ruhe, maximal leichte Einschränkung der täglichen Aktivitäten) auf.
Metabolische (Kontraktions-)Alkalose mit konsekutiver Hypokaliämie
Die metabolische Alkalose ist eine häufige Störung des Säure-Basen-Haushaltes (bis zu 50% der Störungen bei hospitalisierten Patientinnen und Patienten). Sie ist definiert durch einen pH-Wert >7,42 und eine Bikarbonatkonzentration von >26 mmol/L. Sie geht mit einer Akkumulation von Bikarbonat einher. Die häufigsten Ursachen sind ein Verlust von Magensäure und eine Diuretika-Einnahme. Diese führen zu einem Volumenmangel und in Folge zu einer vermehrten Aldosteronausschüttung, die wiederum eine Reabsorption von Bikarbonat zur Folge hat.
Je nachdem, ob die Alkalose durch eine i.v.-Substitution von Natriumchlorid beeinflussbar ist, bezeichnet man sie als chloridsensitiv oder nicht-chloridsensitiv. Erstere wird wie auch im vorliegenden Fall durch eine intravenöse Substitution von Natriumchlorid sowie Kaliumchlorid behandelt, um eine Wiederherstellung des arteriellen Volumens und somit einen Ausgleich des alkalischen Milieus zu erreichen. Bei schweren metabolischen Alkalosen ist die intravenöse Gabe von L-Argininhydrochlorid indiziert, da diese Aminosäure zum einen im sauren Milieu liegt und somit zu einer Senkung des pH-Wertes führt und zum anderen eine hohe Chlorid-Konzentration aufweist.
Unsere Patientin präsentierte sich initial mit einer massiven Hypokaliämie von 1,5 mmol/L (als Notfall definiert ab Serumkalium <3,0 mmol/L ). Dieser für metabolische Alkalosen typische Elektrolytmangel kann zu lebensgefährlichen Herzrhythmusstörungen führen, weshalb eine kontrollierte Steigerung des Serumkaliums unter intensivmedizinischer Überwachung unerlässlich ist. Eine i.v.-Gabe sollte mit maximal 20 mmol/h erfolgen, da das Auslösen von Herzrhythmusstörungen nicht auszuschließen ist. Wir verabreichten zur Stabilisierung des Kaliums zudem eine 5prozentige Glucoselösung und ab dem zweiten Tag einen Aldosteronantagonisten.
Fazit
Dank einer raschen intensivmedizinischen Behandlung konnte trotz der anfänglich kritischen Situation der Patientin eine Rekompensation der Rechtsherzbelastung und eine Normalisierung der Stoffwechsellage erreicht werden. So war die Durchführung weiterer Diagnostik und die Stabilisierung bis zum optimalen Zeitpunkt für die Operation möglich. Dadurch verbesserte sich die Prognose, der Eingriff konnte im Verlauf erfolgreich durchgeführt und die Patientin in eine kardiologische Rehabilitationsbehandlung entlassen werden.
Literatur
- A. Murday; Heart. Optimal management of acute ventricular septal rupture; 2003 Dec; 89(12): 1462–146
- B Suder, L Janik. Post-myocardial infarction ventricular septal defect. Is it better to operate on a fresh infarction or to wait? A case study. 2016 Mar; 13(1): 39–41.
- M. Kimmel. Metabolische Alkalose. Dialyse aktuell 2016; 20(04): 186-189; DOI: 10.1055/s-0042-106435

