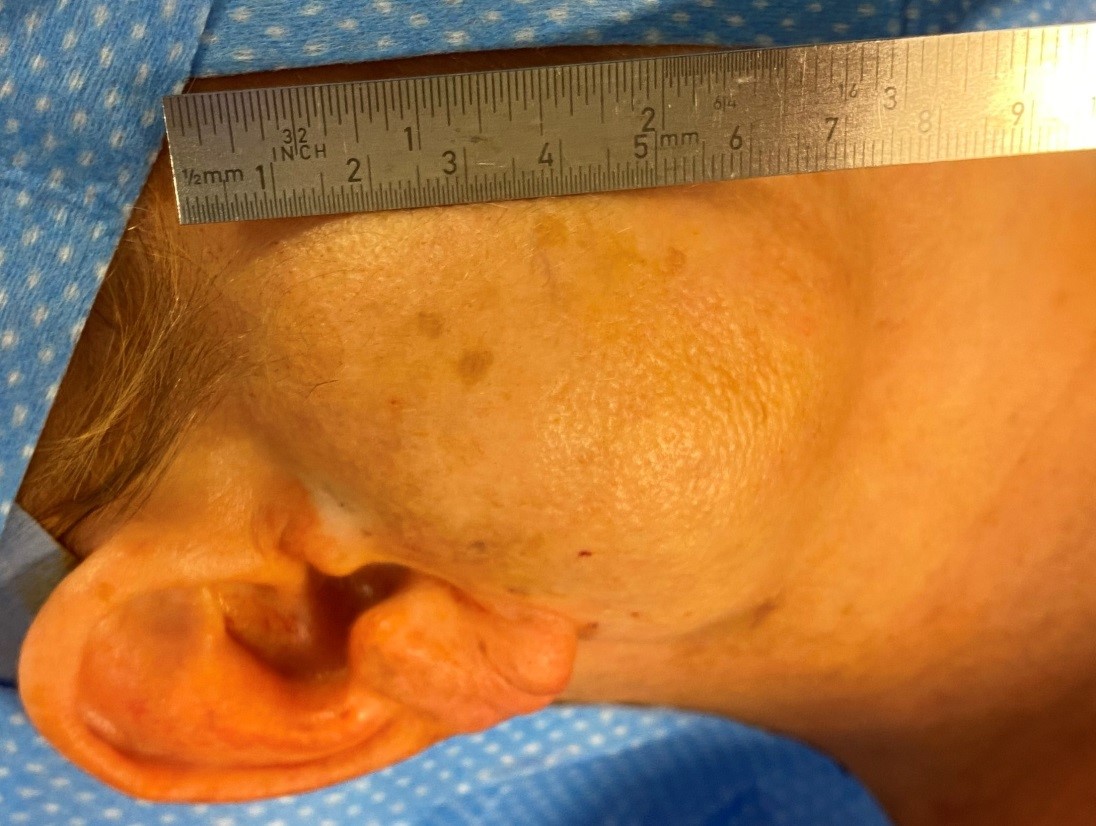
Weiterführende Informationen und Differentialdiagnostik zur Zertifizierten Kasuistik: Langsam progrediente Schwellung der Wange
Folge 70 der Reihe Zertifizierte Kasuistik
von Thorsten Send und Klaus W. G. Eichhorn
Einleitung
In der vorliegenden Kasuistik handelte es sich um ein phleomorphes Adenom, also einen gutartigen langsam wachsenden Speicheldrüsentumor, der nicht nur im Bereich der Ohrspeicheldrüse (80 % der Fälle), sondern auch an den kleinen Speicheldrüsen beispielsweise parapharyngeal (5 %) auftreten kann (1). Die Größe der vorliegenden Raumforderung und der lange symptomlose Krankheitsverlauf ohne Fazialisparese können ein Hinweis auf das Vorliegen eines benignen Tumors sein. Zirka 70 Prozent aller Tumoren der Glandula parotidea sind gutartig. Das phleomophe Adenom kann in bis zu 8 Prozent der Fälle sekundär entarten, meist bei Tumoren die > 10 Jahre bestehen (Carcinoma ex pleomorphes Adenom) (2–5).
Differentialdiagnose und Diagnostik
Differentialdiagnostisch müssen bösartige Tumore ausgeschlossen werden. Bei 65 bis 80 Prozent aller Speicheldrüsenmalignome zeigen sich keine typischen Symptome wie beispielsweise Schmerzen, Fazialisparese, Hautinfiltrationen oder Lymphknotenmetastasen, sondern lediglich singuläre Raumforderungen (3). Sollte eine Fazialisparese im Zusammenhang mit einen Tumor der Ohrspeicheldrüse auftreten, ist dies ein dringlicher Hinweis auf die Möglichkeit des Vorliegens eines Malignoms (schlechtere Prognose) (6). Bösartige Tumore sind von benignen Raumforderungen auch bildmorhologisch – zum Beispiel sonographisch – nicht immer eindeutig zu unterscheiden, weshalb bei Raumforderungen der Glandula parotidea immer eine operative Exstirpation erfolgen sollte.
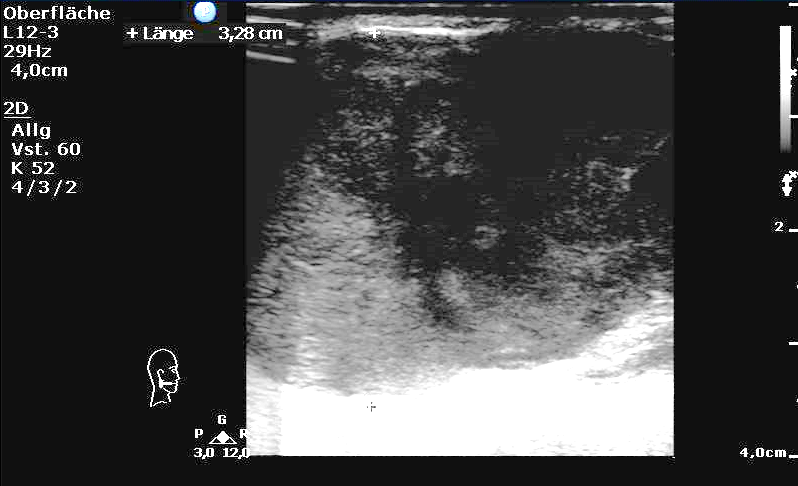
Die Sonographie (Linearschallkopf) ist wie auch in unserem Fall das Mittel der Wahl zur Erstdiagnostik und liefert hochauflösende Bilder, die auch Veränderungen unter 1 cm morphologisch gut darstellt. Hierin ist ein wesentlicher Vorteil im Vergleich zu Standardschichtungen bei Computer- und Kernspintomographien (CT, MRT) zu sehen. Weiterhin ist diese grundsätzlich direkt in der Praxis leistbar und kosteneffizient. Sie ist auch eine geeignete Möglichkeit für Verlaufskontrollen.
Gerade bei Erkrankungen der oberflächlich gelegenen großen Kopfspeicheldrüsen ist eine gute Beurteilbarkeit der Drüsenarchitektur, des Gangsystems (Entzündungen, Speichelsteine), von Tumoren (Zyste vs. solider Tumor) sowie der Lagebeziehung zu den umgebenen Strukturen möglich (7). Wenn - wie in unserem Fall - die Raumforderung sehr groß ist oder in den tieferen Parotisanteilen liegt, kann eine MRT oder ein CT ergänzend sinnvoll sein.
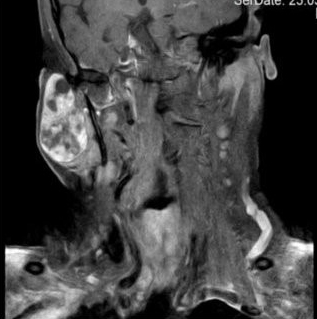
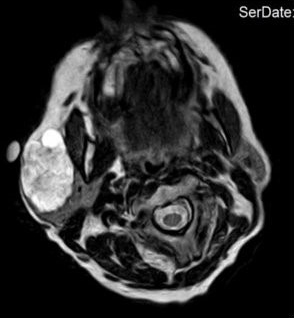
Operation
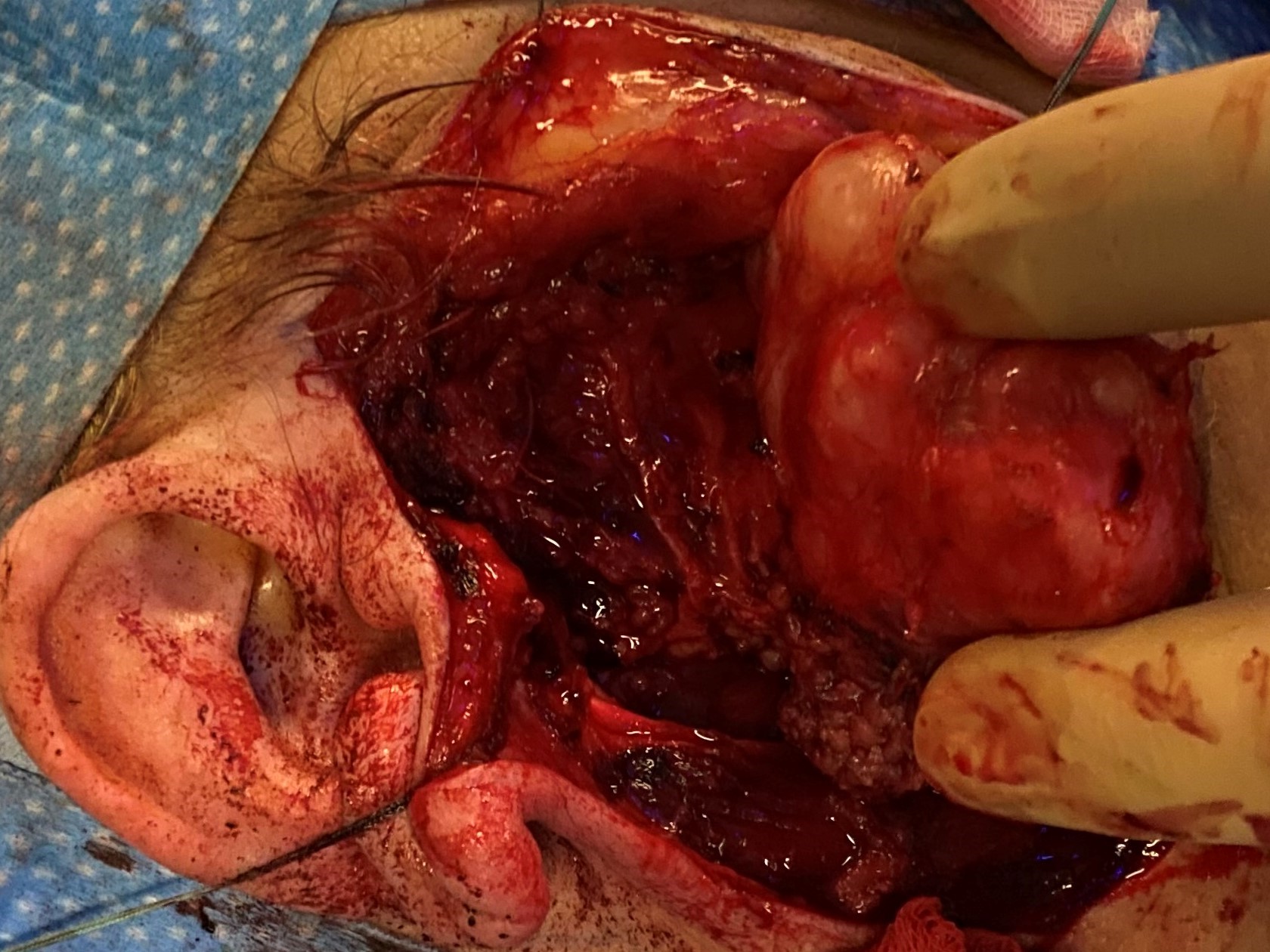
Bei der Operation ist das Hauptaugenmerkt auf die Schonung des Nervus facialis zu legen, der mit seinen Ästen (Ramus colli, R. marginalis, R. zygomaticus, R. buccalis, R. frontalis) direkt durch die Glandula parotidea verläuft. Während der Operation wird üblicherweise der Nerv mittels Neuromonitoring überwacht. Hierbei werden Elektroden in die Gesichtsmuskulatur eingestochen, die auftretende Nervenpotentiale gemessen. Somit kann intraoperativ die Sicherheit für den Patienten erhöht werden. Es gibt verschiedene modifizierte Schnittführungen, die alle ein Augenmerk auch auf ein gutes kosmetisches Ergebnis haben.
Standardmäßig beginnt die Schnittführung im Bereich des Tragus, führt am Lobulus auriculae nach dorsal und läuft bogenförmig parallel zum Unterkiefer aus. Der Fazialishauptstamm wird zwischen den Landmarken dem Pointer (einer knorpeligen Aussziehung des Gehörgangs) und dem Musculus digastricus aufgesucht und die Äste in die Peripherie verfolgt.
Wir führen mittlerweile routinemäßig eine intraoperative Schnellschnittuntersuchung durch, um bei einem möglichen malignen Befund direkt eine totale Parotidektomie unter Erhalt des Nervus facialis durchzuführen. Hierdurch kann eine Revisionsoperation mit erhöhter Gefährdung des Nervens unter erschwerten Operationsbedingungen vermieden werden. Kommt a priori eine Resektion des Nervus facialis in Frage, so sollten verschiedene Rehabilitationsmassnahmen auch gleich mit dem Patienten besprochen werden.
Der abschließende histopathologische Befund ergab ein pleomorphes Adenom. Makroskopisch zeigte sich ein knotiges Präparat mit einer zarten kapselartigen Überkleidung und einer glänzenden, rötlichen Oberfläche.
Die mikroskopische Untersuchung zeigte in einer chondroiden und myxoiden Matrix myoepitheliale solide und trabekulär konfigurierte Zellproliferate. Stellenweise zeigten sich orthokeratotische Verhornungen des Epithels. Zusätzlich konnten zwei tumorfreie intraparotideale Lymphknoten identifiziert werden.
Postoperative Komplikationen
Mögliche postoperative Komplikationen sind vorübergehende Hämatome, Gefühlsstörungen am Ohrläppchen, temporäre Gesichtsnervenschädigungen, „Kauschwitzen“ (Frey-Syndrom) oder Speichelfisteln. Sollte es postoperativ zu einer Speichelfistel, Kauschwitzen oder einer Sialozele kommen, kann diese beispielsweise mit einem Druckverband oder Botulinumtoxin behandelt werden (8, 9).
Bisher existiert eine Leitlinie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF) zum Thema „Obstruktive Sialadenitis“ (S2k). Eine weitere Leitlinie zum Thema „Diagnostik und Therapie der Speicheldrüsentumore des Kopfes“ ist zur Fertigstellung September 2021 geplant (10).
Abschließende Beurteilung
Es handelt sich bei diesem Tumor um ein gutartiges pleomorphes Adenom mit einer außergewöhnlichen Größe. Das langsame beschwerdefreie Wachstum ist hierfür typisch. Tumoren der Ohrspeicheldrüsen sollten operativ entfernt werden, da nur so ein Malignom oder eine maligne Entartung im Verlauf ausgeschlossen werden können. Bei kompletter Entfernung hat das pleomorphe Adenom eine Rezidivrate von unter 5 Prozent.
Literatur
- Bootz F, Greschus S, van Bremen T. Therapie parapharyngealer Tumoren: Therapie parapharyngealer Tumoren: Springer; 2016 [cited 2020 Dec 23]. Available from: URL: link.springer.com/article/10.1007/s00106-016-0259-y.
- Eneroth CM, Blanck C, Jakobsson PA. Carcinoma in pleomorphic adenoma of the parotid gland. Acta Otolaryngol 1968; 66(6):477–92.
- Lang S, Rotter N, Lorenzen A, Ihrler S, Eckel R, Hölzel D et al. Speicheldrüsenkarzinome Teil I: Epidemiologie, Atiologie, Malignitätskriterien, Prognoseparameter und Klassifikation. HNO 2005 [cited 2020 Dec 23]; 53(9):817-26; quiz 827-8.
- Jürgen Strutz Wm, editor. Praxis der HNO-Heilkunde, Kopf- und Halschirurgie. 2.th ed. Suttgart, New York: Thieme; 2010.
- Chilla R. Die Behandlung rezidivierender pleomorpher Adenome. HNO 1997; 45(12):955–6.
- Johns ME. Parotid cancer: a rational basis for treatment. Head Neck Surg 1980; 3(2):132–41.
- Zenk J, Iro H, Klintworth N, Lell M. Diagnostic imaging in sialadenitis. Oral Maxillofac Surg Clin North Am 2009; 21(3):275–92.
- Send T, Bertlich M, Eichhorn KW, Bootz F, Jakob M. Management and Follow-up Results of Salivary Fistulas Treated With Botulinum Toxin. Laryngoscope 2019; 129(2):403–8.
- Laskawi R, Rohrbach S. Frey's syndrome. Treatment with botulinum toxin. Curr Probl Dermatol 2002; 30:170–7.
- Al-Nawas B, Beutner D, Geisthoff U, Naujoks C, Reich R, Schröder U et al. Die neue S2k AWMF Leitlinie zur Behandlung der obstruktiven Sialadenitis in kommentierter Kurzform. Laryngorhinootologie 2014; 93(2):87–94.