von Andreas Wagner
Inhalt
Diagnose
Die Anamnese des noch jungen Patienten mit Atemnot, Tachycardie, Blässe und Teerstuhl ist beweisend für die Diagnose einer gastrointestinalen Blutung. Insbesondere bei perakuten Blutungen ist es die Tachycardie, welche zuerst klinisch apparent wird. Das Hämoglobin reagiert oft erst mit einer deutlichen zeitlichen Verzögerung.
Das Leitsymptom Teerstuhl lässt keine sichere Differenzierung zwischen oberer und unterer GI-Blutung zu. Daher muss in dieser Situation immer zuerst eine Magenspiegelung erfolgen, da obere GI-Blutungen in aller Regel gefährlicher sind als untere und da die Magenspiegelung keiner gesonderten Vorbereitung bedarf, abgesehen davon, dass der Patient nüchtern sein sollte. Vorsicht ist geboten bei Hämatemesis. Hier muss rechtzeitig an eine Schutzintubation gedacht werden, um bei V.a. auf noch bestehende Blutung eine Aspiration zu verhindern.
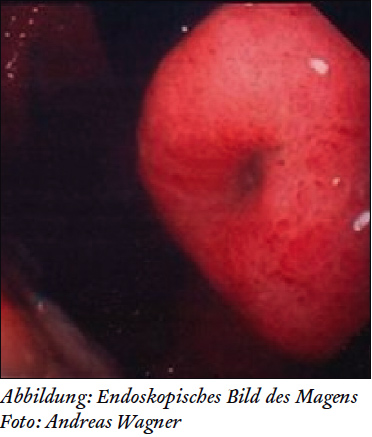
Die Magenspiegelung zeigt das typische Bild eines submukosalen Tumors mit zentraler Eindellung und darüber liegender, normal aussehender Mukosa.
Differentialdiagnostik
Grundsätzlich muss jeder subepitheliale / submukosale Tumor im oberen GI-Trakt via Endosonographie weiter abgeklärt werden. Die Endosonographie ermöglicht die eindeutige Zuordnung einer Raumforderung zu den Wandschichten. Dies ist für die Differentialdiagnose von entscheidender Bedeutung, da zum Beispiel Lipome von der Submukosa und GIST (gastrointestinale Stromatumore) von der muscularis propria ausgehen. Auch Gefäße und zum Beispiel Pankreasheterotopien lassen sich sehr gut von GIST abgrenzen.
Epidemiologie
GIST sind die häufigsten mesenchymalen Tumore des Gastrointestinaltraktes. 65 Prozent treten im Magen, 30-35 Prozent im Dünndarm und 5-10 Prozent im Dickdarm auf. Leiomyome, die ebenfalls von der Muskularis ausgehen, sind im Magen dagegen selten. In der Speiseröhre sind von der Muskularis ausgehende Raumforderungen zumeist Leiomyome.
Therapie
Da GIST ein malignes Potential aufweisen, müssen sie entweder kontrolliert oder aber entfernt werden. In aller Regel kommt eine endoskopische Entfernung nicht in Frage. Die Resektion eines Prozesses aus der muscularis propria birgt ein sehr hohes Perforationsrisiko. Ausnahme sind lediglich die seltenen GIST, die von der muscularis mucosae ausgehen. Hier ist die endoskopische Entfernung durchaus möglich. Ansonsten sollte eine laparoskopische Keilresektion angestrebt werden, oft ist es hilfreich dem Operateur die Lage des GIST im Magen durch eine intraoperative Endoskopie anzuzeigen.
Für die Planung der Therapie ist eine Risikostratifizierung erforderlich.
Insbesondere die Größe gilt als wesentlicher Risikofaktor und GIST >2 cm sollten wenigstens biopsiert oder ganz reseziert werden. Bei kleineren GISTs im Magen kann eine Kontrolle ausreichend sein. Ich persönlich neige allerdings dazu, gerade bei jüngeren Patienten auch bei einer Größe zwischen 1 und 2 cm eine laparoskopische Keilexzision zu empfehlen. Die Alternative wären jährliche Endosonographien, was bei zum Beispiel einem 40-jährigen Patienten dann 40 oder 50 Untersuchungen im Laufe des Lebens bedeuten könnte.
Die Lage ist ebenfalls prognostisch bedeutsam. Für GISTs der Vagina und des Rektums gilt der Zusammenhang zwischen Größe (>2 cm) und dem Risiko maligner Entartung nicht. Stattdessen sollen GISTs in Rektum und Vagina immer komplett reseziert werden.
Neben der Größe und der Lokalisation ist vor allem das histologische Bild mit der Anzahl der Mitosen, pro 50 HPF (High-Power-Fields) bei 400-facher Vergrößerung ausgezählt, entscheidend für das Risiko. Mehr als 10 Mitosen gelten dabei als hohes Risiko, unter 5 als niedriges Risiko und 6-10 als intermediäres Risiko. Das bedeutet, dass auch ein kleiner GIST mit einer hohen Mitoserate in der Biopsie zu resezieren ist.
Die definitive Diagnose beruht auf dem immunhistochemischen Nachweis der Expression von CD117 (KIT) Rezeptoren, wenn auch 5 Prozent echter GISTs CD117 negativ sein können.
Ferner kann die molekularbiologische Analyse von Mutationen im KIT Rezeptor und auch im PDGRF A Rezeptor (platelet derived growth factor receptor A) hilfreich sein, gerade bei den CD117 negativen Fällen. Schließlich kann die molekularbiologische Analyse Bedeutung haben, insofern als es cKIT Mutationen gibt, die die Therapie mit Imatinib negativ beeinflussen.
Risikostratifizierung bei GIST | |||||
|---|---|---|---|---|---|
| Tumorparameter | Risiko einer Krankheitsprogression (%) | ||||
| Mitoseindex | Größe | Magen | Duodenum | Jejunum/Ileum | Rektum |
| ≤ 5 per 50 hpf | ≤2 cm | keines 0% | keines 0% | keine 0% | keines 0% |
| ≤ 5 per 50 hpf | > 2≤ 5 cm | sehr niedrig 1,9% | niedrig 4,3% | niedrig 8,3% | niedrig 8,5% |
| ≤ 5 per 50 hpf | > 5≤ 10 cm | niedrig 3,6% | moderat 24% | insuffiziente Daten | insuffiziente Daten |
| ≤ 5 per 50 hpf | > 10 cm | moderat 10% | hoch 52% | hoch 34% | hoch 57% |
| > 5 per 50 hpf | ≤ 2 cm | keines (Fallzahl ¯) | Hoch (Fallzahl ¯) | insuffiziente Daten | hoch 54% |
| > 5 per 50 hpf | > 2≤ 5 cm | moderat 16% | hoch 73% | hoch 50% | hoch 52% |
| > 5 per 50 hpf | > 5≤ 10 cm | hoch 55% | hoch 85% | insuffiziente Daten | insuffiziente Daten |
| > 5 per 50 hpf | > 10 cm | hoch 86% | hoch 90% | hoch 86% | hoch 71% |
NCCN Task Force report: Optimal Management of Patients with GIST – Update of the NCCN Clinical Practice Guidelines (Tabelle entnommen : http://www.gist-register.at/gist/risikoeinteilung.html)
Im Falle eines malignen GIST sollte das Staging mittels CT-Untersuchung erfolgen, lediglich im kleinen Becken ist die MRT vorzuziehen.
Medikamentöse Therapie
Neben der Operation steht beim malignen und metastasierten GIST der Tyrosinkinasehemmer Imatinib zur Verfügung. Imatinib ist entwickelt worden als Hemmer der c-abl Kinase beziehungsweise des bcr-abl Fuisonsproteins, das bei CML eine wesentliche Rolle in der Pathogenese spielt. Es hat sich gezeigt, dass Imatinib daneben auch die Tyrosinkinaserezeptoren PDGF-Rezeptor und KIT hemmen kann. Standardtherapie ist die Dosis von 400 mg, wobei im Falle eines Therapieversagen zunächst eine Dosissteigerung auf 800 mg oft helfen kann. Als Zweitlinientherapie ist danach der Tyrosinkinasehemmer Sunitinib etabliert.
In bestimmten Fällen kann eine adjuvante Therapie mit Imatinib berechtigt sein. Dies gilt besonders bei sehr großen GIST mit hoher Mitoserate. Daten zur Verlängerung der Überlebenszeit durch eine adjuvante (postoperative) Therapie liegen nicht vor. Allerdings gibt es eine Studie, die ein verlängertes rezidivfreies Intervall bei Hochrisikopatienten zeigen konnte.
Auch die neoadjuvante (präopeative) Therapie mit Imatinib kann indiziert sein. Dies gilt insbesondere dann, wenn sehr große GIST schlecht operabel erscheinen und die Hoffnung besteht durch Zytoreduktion ein besseres operatives Ergebnis erzielen zu können.
Das Ansprechen kann zumeist mittels CT und Nachweis des Wachstumsverhaltens gut verfolgt werden. In den Fällen, in denen bei großen Tumoren versucht wird, präoperativ mit Imatinib eine Tumorregression mit dann besserer Operabilität zu erreichen, kann mittels FDG-PET das Ansprechen der Therapie kurzfristig überprüft werden.
Die Nachsorge bei malignen Hochrisiko-GISTs beinhaltet CTs alle 3 bis 4 Monate für 3 Jahre, danach alle 6 Monate bis 5 Jahre erreicht sind. Bei den Niedrigrisiko GISTs genügen halbjährliche CTs für insgesamt 5 Jahre.
Literatur
- Gastrointestinal stromal tumors: ESMO Clinical Recommendations for diagnosis, treatment and follow-up P. G. Casali1, L. Jost, P. Reichardt, M. Schlemmer & J.-Y. Blay. Annals of Oncology 19 (Supplement 2): ii35–ii38, 2008
- Kinase Mutations and Imatinib Response in Patients With Metastatic Gastrointestinal Stromal Tumor. Michael C. Heinrich, Christopher L. Corless, George D. Demetri, Charles D. Blanke, Margaret von Mehren, Heikki Joensuu, Laura S. McGreevey, Chang-Jie Chen, Annick D. Van den Abbeele, Brian J. Druker, Beate Kiese, Burton Eisenberg, Peter J. Roberts, Samuel Singer, Christopher D.M. Fletcher, Sandra Silberman, Sasa Dimitrijevic, and Jonathan A. Fletcher. Journal of Clinical Oncology, Vol 21, No 23 (December 1), 2003: pp 4342-4349
- Demetri GD, van Oosterom AT, Garrett CR et al. Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib: a randomised controlled trial. Lancet 2006; 368: 1329–1338.
- DeMatteo RK, Owzar KR, Maki R et al. Adjuvant imatinib mesylate increases recurrence free survival (RFS) in patients with completely resected localized primary gastrointestinal stromal tumor (GIST): North American intergroup phase III trial ACOSOG Z9001. ASCO Annual Meetings Proceedings Part I. J Clin Oncol 2007; 25 (18 Suppl):10079.
- Michael C. Heinrich, Christopher L. Corless, George D. Demetri, Charles D. Blanke, Margaret von Mehren, Heikki Joensuu, Laura S. McGreevey, Chang-Jie Chen, Annick D. Van den Abbeele, Brian J. Druker, Beate Kiese, Burton Eisenberg, Peter J. Roberts, Samuel Singer, Christopher D.M. Fletcher, Sandra Silberman, Sasa Dimitrijevic, and Jonathan A. Fletcher. Kinase Mutations and Imatinib Response in Patients With Metastatic Gastrointestinal Stromal Tumor Journal of Clinical Oncology, Vol 21, No 23 (December 1), 2003: pp 4342-4349

